MCIおよびADの研究で評価されたタウPETトレーサーはどれですか?
アルツハイマー病(AD)の病理学的特徴は、 脳内に アミロイドベータ(Aβ) プラークおよび神経原線維変化 が存在することであると長い間認識されて きましたが、FDAが初めてタウPETトレーサー である[18F]フルオロタウシピリド (別名AV-1451、Tauvid®) を承認したのは、つい最近(2020年)のことです 。アルツハイマー病の評価対象である認知障害を持つ成人における凝集タウ神経原繊維の密度と分布を推定するために承認 されました(Barthel, 2020)。 このリガンドの主な 制限事項 は、(1)初期の タウ段階 や 、アルツハイマー病以外のタウオパチー (Soleimani-Meigooni, 2020) や、 (2)特にモノアミン酸化酵素B(MAO-B)への非標的結合の存在 により、 ルーチン臨床応用が制限される可能性があること (Leuzy, 2019)が挙げ られます。[3H]PI2620 、[3H]RO948 、[3H]MK-6240、[3H]JNJ067 などの 第2世代 リガンドに関する 活発な 研究が進行中であり 、これらのリガンドは、 これらの限界を克服する上で 有望な結果を示しています 。フロルタシピルの最近の包括的なレビュー (Burnham, 2024) では、 フロルタシピルの 限界はあるものの、 アルツハイマー病の診断、および潜在的に予後を改善できる、 タウ神経原線維変化の正確 かつ有用な 生体内 マーカー であると 結論づけられています。 しかし 、タウ神経原線維変化に対する感度が高い 第二世代のリガンド([18F]MK-6240) を使用 することで 、認知機能に異常のない人 におけるタウの 早期の縦断的 沈着 を検出できる可能性があります (Pascoal,2021)。

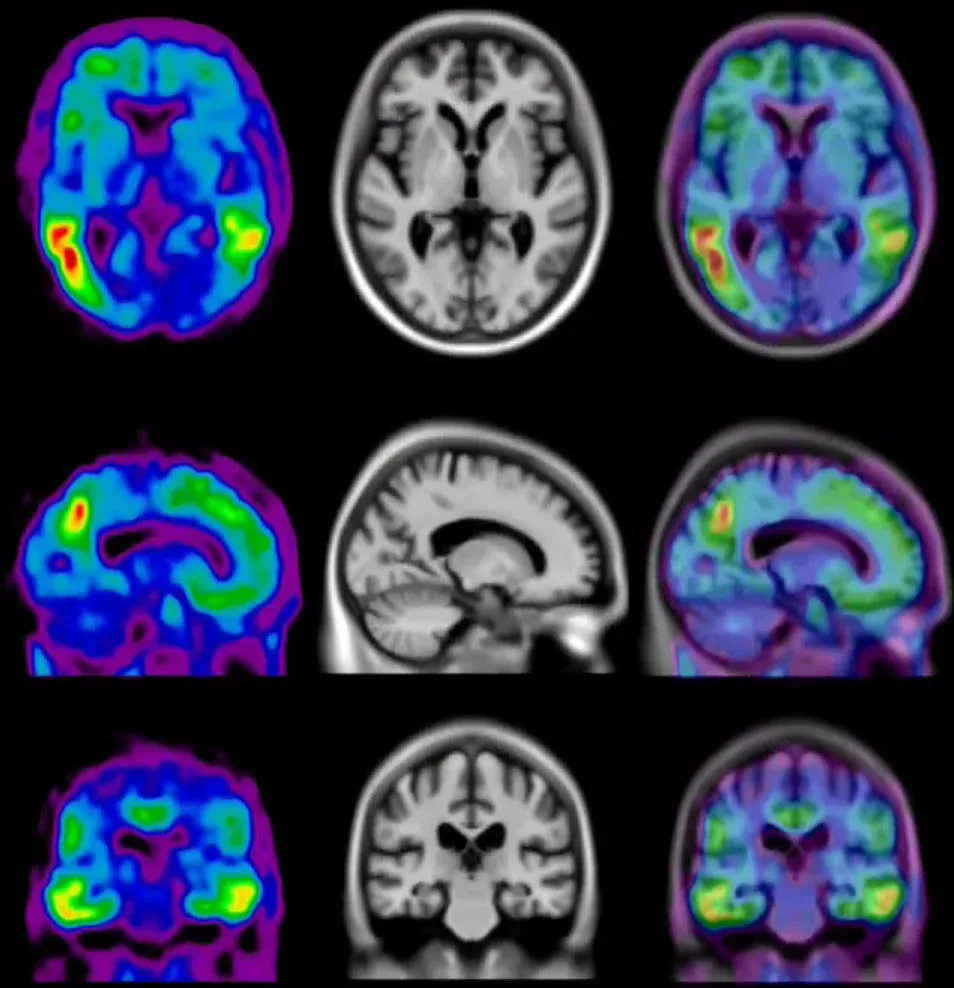
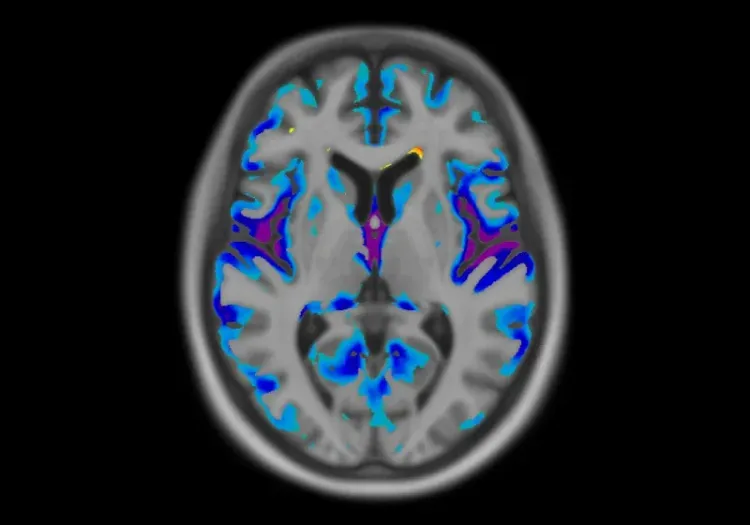
アルツハイマー病患者の コホート で 観察された アミロイドPET と タウPETの平均シグナル の 表面 投影 。挿入図 は 、アミロイドベータプラーク (左)と 神経内タウ封入体 および タングル(右)の免疫組織化学(IHC)染色を示しています。
タウPETは、他のタウバイオマーカー と比較して、 どのように 疾患の進行 を予測する のでしょうか?
Coomans ら (Coomans, 2023 )は最近、血漿タウ(pTau181)、磁気共鳴画像法(MRI)による皮質萎縮、ベースライン認知、アポリポタンパク質E遺伝子(APOE)の状態、 リン酸化タウ-217、神経フィラメント軽鎖(NfL)、またはアミロイドベータ(Aβ)42/40比の 血 漿 および脳脊髄液(CSF)レベル(Smith, 2023)と比較すると、
しかし 、血漿タウマーカーは臨床研究の充実に非常に役立つ可能性があります (Blennow, 2023)。血漿 p-tau181 は、非常に早期の AD 関連タウ凝集を予測できることが示されており、したがって、タウの進行を早期に食い止め、神経変性と認知機能障害の連鎖を潜在的に予防することを目的とした臨床試験において、アミロイド陽性、タウ陰性の患者(タウの蓄積リスクが高い患者)を組み入れる可能性があることから、タウを標的とする薬剤を用いた臨床試験にも関連性があると考えられます。このような事前スクリーニングは、同じ薬剤効果を検出するために登録する必要のある患者数を減らすこともできます (Ferreira, 2023)。
タウPETトレーサーの蓄積の時空間パターンはどのようなものですか?
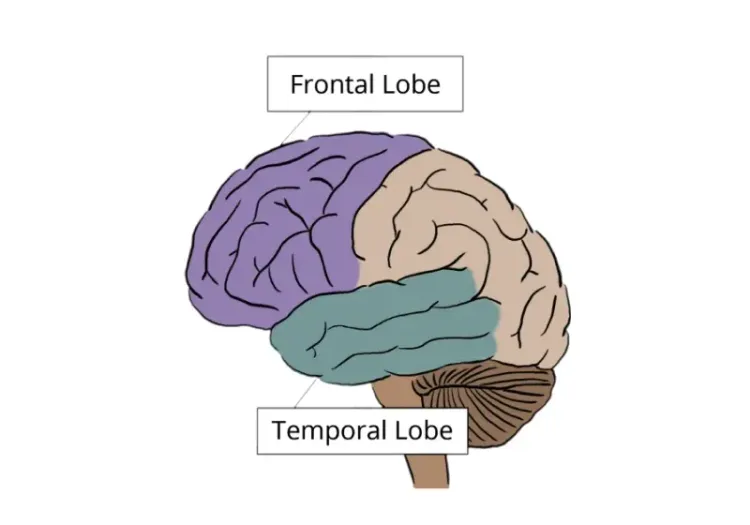
Braak らによる 先駆的な 病理組織学的 調査(Braak,1991) により 、アルツハイマー病における 神経細胞内 神経原線維変化の 特異的な沈着パターン が明らかになりました 。 病理学的変化 は、下図に示されているように、 嗅内野の段階(BraakのステージI/II ) から 辺縁系の段階(BraakのステージIII/IV) へ 、 そして最終的に 新皮質の段階(BraakのステージV/VI) へと進行します。[18F]flortaucipir (AV-1451) を用いた研究 により 、 アミロイドベータが異常な状態にある Braak I/II期の領域で早期にタウが蓄積することが 、 認知機能の低下が始まる患者を特定できることが明らかになりました (Chen, 2021)。 記憶能力の低下が 速いほど 、 アルツハイマー病スペクトラム全体でタウの蓄積速度が速い ことが関連付けられています (Jack, 2020)。認知機能に異常のない人では 、下側頭皮質で最も強い蓄積が経時的に認められました (Insel,2023)。Braakの病期分類システムは、集団レベルでのタウの広がりを適切に説明 していますが、このパターンにうまく当てはまらない 個々のタウのパターンも報告されています (Ossenkoppele, 2016) 。 そのため、タウPET陽性の人々 を対象とした大規模な研究により 、異なる タウ沈着の軌跡 が 異なる 認知障害の進行 と関連していることが明らかになりました。これは 、 今後の臨床試験の計画を立てる上で考慮すべき 重要な点である可能性があります (Vogel, 2021)。
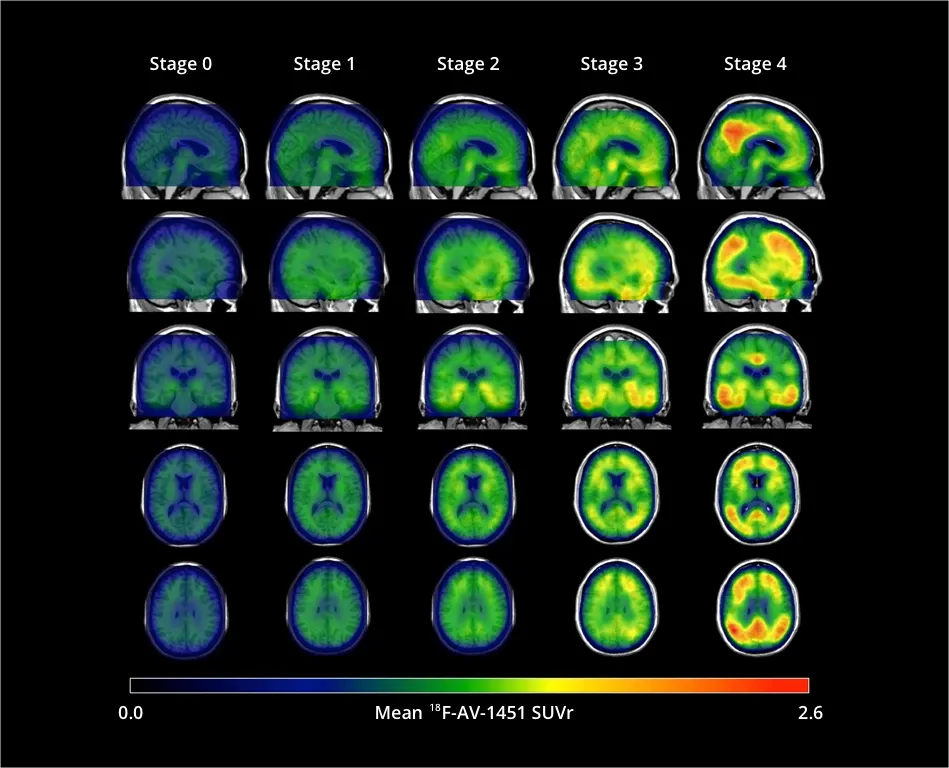
[18F]flortaucipir (AV-1451)の信号(標準化取り込み値比(SUVR)) は、ステージ0からステージ4にかけて、皮質および皮質下全体で増加します 。ステージ0の参加者は、正常な若年成人のタウ値と同等の値を示しました。内側側頭領域(Braak I/II の関心領域)におけるタウの著しい上昇 はステージ1で示されました 。ステージ2 では側頭葉外領域で SUVRの 増加が見られ 、ステージ3 では下側頭葉および側頭葉を含むBraak III/IV ROIで より大きな SUVR の増加 が見られました 。ステージ4では 、[18F]AV-1451 SUVRが著しく上昇 し、大脳皮質にまで広がりました。図はChenら(2021年) より 、クリエイティブ・コモンズ表示ライセンスに基づき 転載したものです。
PETトレーサー分析においてすべての被験者に同じROI を使用するのではなく 、被験者ごとに 特定の関心領域(ROI) を使用することで、 対象特異的な 地域的多様 性とタウの 経時的 蓄積 を分析する複雑 性を 克服できる可能性があります。このアプローチ により 、 すべての臨床グループにおけるタウSUVR の年間 変化の検出が 大幅に 増加 し、 サンプルサイズが大幅に減少 することが示 されています (Leuzy, 2023)。
MCI/ADの臨床試験において、 タウPETの変化 は示されているのでしょうか?
アミロイドベータ標的療法の歴史的な限定的な 成功 により、タウ標的療法の開発へとシフトしました。現在、タウオパチーの治療法として、抗体媒介性除去、遺伝子発現の減少、低分子阻害剤などのいくつかの潜在的な治療戦略が研究されています (Singh,2024)。
現在研究されている治療薬のほとんど は、タウ免疫療法に焦点を当てています。タウPETを探索的エンドポイントとして含めた抗体媒介クリアランスの初期第2相試験(例 :zagotenemab、gosuranemab)では、タウPET標準化取り込み値比(SUVR)の調整平均変化に有意な変化は認められませんでした (Fleisher, 2024;Shulman, 2023)。 1 つの抗体(E2814)は、優性遺伝型アルツハイマー病患者において、有望な安全性、薬物動態、およびCSF標的結合プロファイルを示し、現在、主要評価項目がタウPET信号の変化である第3相試験の一部として研究が進められています (Zhou, 2023)。
遺伝子発現の減少 という 観点では、アンチセンスオリゴヌクレオチド(ASO)が有望な治療アプローチとなる可能性があります。タウを標的とするアンチセンスオリゴヌクレオチド(MAPT-RX)を用いた第1相試験では、用量依存的なCSF総タウ濃度の減少が示されました が(Mummery,2023)、 一方 、BIIB080(MAPT-Rx)のフェーズ2試験が現在進行中で、予備的な調査結果では、評価されたすべての脳領域でTau PETシグナルの減少が示されています (Edwards, 2023)。
当社の知る 限り、低分子タウ阻害剤を治療薬として使用し、タウPETの変化を最終評価項目とした臨床試験の結果は発表されていません(2024年9月現在)。しかし、タウを標的とした臨床試験のバイオマーカー戦略にとって重要であると判断されたため、次世代の試験ではタウPETが組み込まれる可能性が高いです (Penny, 2024)。
MCIおよびアルツハイマー病におけるタウPETの経時的変化に関するご質問、または当社の他のイメージングサービスに関する具体的な情報提供など、当社のチームが喜んで対応いたします。
当社のイメージングサービスについてさらに詳しく知る
関連コンテンツ
神経疾患の臨床試験における神経画像診断の使用に関するベストプラクティスの最新情報。
神経疾患におけるタンパク質の異常折りたたみのモデリング
神経変性におけるタンパク質のミスフォールディングのメカニズムの計算モデル化と、疾患修飾治療薬の発見と開発への応用。
前頭側頭型認知症における神経画像診断と臨床試験
前頭側頭型認知症(FTD)の変異型に対する理解におけるMRIおよびPET画像診断によるバイオマーカーの有用性、およびFTD臨床試験におけるエンドポイントとしてのその使用。
MS臨床試験におけるガドリニウム造影MRI病変
多発性硬化症(MS)の臨床試験におけるガドリニウム(Gd)による病変の増強が、疾患の進行と治療介入への反応を追跡するためにどのように使用されているか。
進行性核上性麻痺(PSP)の画像診断バイオマーカー
PSPの臨床試験において、疾患修飾療法の有効性を評価するために利用可能な各種の脳画像診断法(MRI、PET、SPECT)の概要。
CBDと他のタウオパチーを区別するバイオマーカーのイメージング
脳画像バイオマーカーの概要と、それを用いた大脳皮質基底核変性症(CBD)患者の特定、および疾患修飾療法の臨床試験におけるその使用。
多系統萎縮症(MSA)の臨床試験におけるMRI
この資料では、MSAの研究におけるバイオマーカーとしての体積MRIと拡散強調画像(DWI)の有用性について概説しています。