神経疾患において、折り畳み異常タンパク質はどのような役割を果たしているのでしょうか?
ミスフォールドタンパク質のダイナミクス入門
タンパク質はアミノ酸で構成される巨大分子であり、正しい折りたたみ構造により、生物学的環境に長期的な安定性をもたらします。 これに対し、適切な折りたたみが失敗すると、さまざまな病理学的状態と関連することが一般的です(Dobson, 2003 ;Nassar, 2021 )。したがって 、正しく折りたたまれなかったタンパク質はミスフォールドタンパク質(MP)と呼ばれ、アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)、クロイツフェルト・ヤコブ病(CJD)、およびその他のいくつかのヒト神経変性疾患(Scheckel, 2018 ;Mehra,2019年 、Lövestam、2023年 、Michaels、2023年 )。
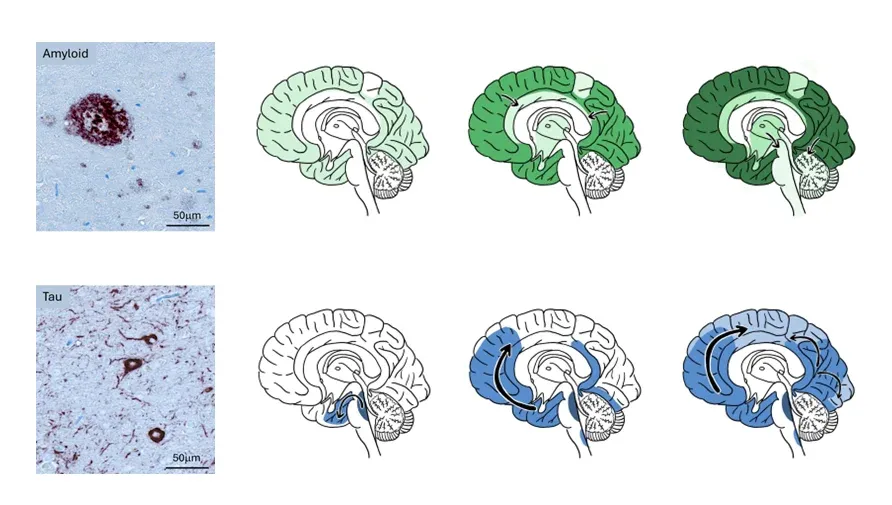
アルツハイマー病は、Aβとタウの凝集タンパク質の異なる微視的パターンによって特徴づけられ、大脳皮質におけるAβとタウ凝集体の解剖学的進行パターンが特徴的になります。
細胞における毒性効果を完全に理解するためには、ミスフォールディングタンパク質プロセスを取り巻く一連の本質的なメカニズムを完全に解明する必要があります(Eisele, 2016 ;Lewis, 2016 )。このようなメカニズムには、MPのシード、凝集、伝播および/または拡散が含まれます。したがって、これらのMP関連メカニズムの時間経過における特定の兆候は、通常、MPダイナミクスと呼ばれます。 構造疾患特有の誘発事象の特定における主な障害は、MPダイナミクスの分子レベルでの影響をより巨視的なスケールに外挿する能力です。
ミスフォールドタンパク質の数学モデル
数学モデルは、生物学的プロセスの真のダイナミクスを可能な限りシミュレーションし再現することを目的とした理論的環境です。 微分方程式で表現される数学モデルは、時間的相互作用プロセスにおける非線形および複雑なダイナミクスを容易に再現できるため、自然な選択肢となります。ミスフォールドタンパク質という文脈において、数学モデルは2つの大きなカテゴリーに分類できます。シード、凝集、細胞間の短距離空間伝播のような分子レベルのプロセスをシミュレーションするモデルと、人間の脳内での長距離MP伝播のようなより巨視的な相互作用をシミュレーションするモデルの2つに分類されます。このような分類をすると、ミクロなスケールのモデルは主に化学反応速度論の分野で開発されてきたことが分かります。一方、より大きなスケール(すなわちマクロな)モデルは、主に神経画像研究の枠組みの中で提案されてきました。
プリオン様ダイナミクス
プリオン病もまたMPプロセスであると考えられるため(Scheckel, 2018 )、MPの先駆的な数学モデルがプリオンの複製と凝集の生物学的メカニズムをシミュレートすることは自然なことでした(Eigen, 1996 )。常微分方程式(ODE)に基づく初期のプロトタイプモデルは広く受け入れられ、現在では核生成重合モデル(NPM)として知られています(Nowak, 1998 )。このモデルは、典型的なプリオンタンパク質が感染因子タンパク質に変換されるメカニズムを説明することを目的とした自己触媒メカニズムに焦点を当てています。注目すべきことに、Nowak ら(Nowak, 1998 )は、NPM に含まれるタンパク質の複製と凝集のメカニズムが、ウイルスの動態を説明する一般的な疫学モデルに見られる力学と類似していることに気づきました。したがって、MP の伝播を説明する現代的な巨視的モデルが、確固とした疫学モデルから着想を得ていることは驚くことではありません。
プリオン動態のNPMを基礎として確立することで、いくつかの研究(Petkova, 2005 ;Frost, 2009 )では、α-シヌクレイン、タウ、Aαタンパク質の線維凝集体が、プリオン凝集/伝播について説明されているものと同様の生化学的メカニズムによって自己伝播することが実証されています。これらの観察結果は、いくつかの生体内動物モデルと併せて、神経変性疾患の進行に関するいわゆる「プリオン様仮説」の基礎を確立しました(Frost, 2010 )。それ以来、プリオン様仮説では、MPの「感染性」は、病原性タンパク質の濃度が高い初期のシード領域から、他の「非感染性」の脳領域へと伝播します。
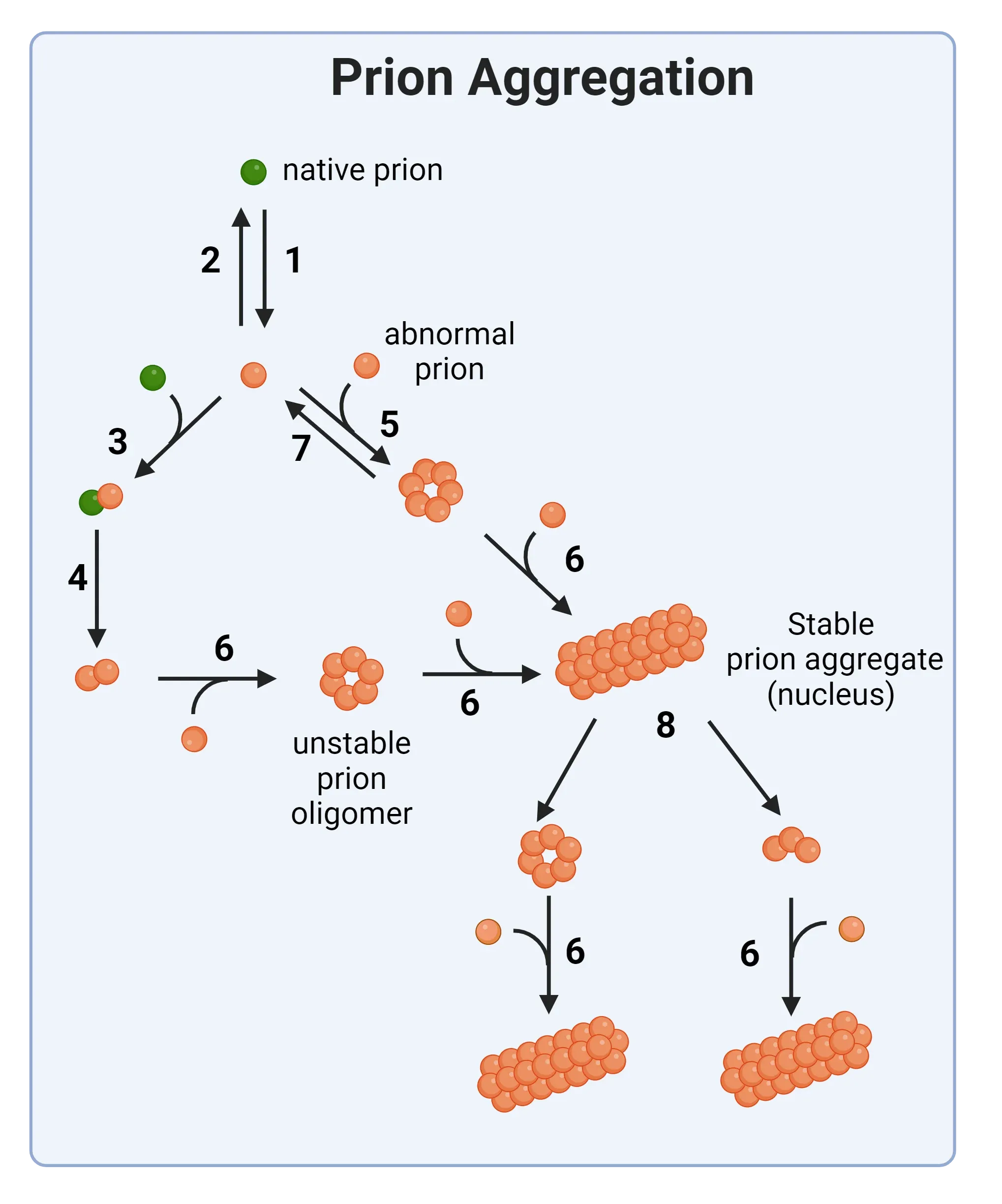
プリオン凝集メカニズムの概略図。 天然プリオン分子は、異常な構造へと導く構造変化を起こします(ステップ1)。 そこから、いくつかのシード化および凝集ステップを経て、不安定なプリオンオリゴマーが形成され、最終的に安定したプリオン凝集体が生成されます。
MP伝播:空間的拡散
MP動態の研究における画期的な進展は、ペインら(Payne, 1998 )によってもたらされました。ペインらは、以前に動物モデルで観察されていた末梢神経系(PNS)における感染因子タンパク質の発生と、中枢神経系(CNS)におけるその発生との間の潜伏期間について、妥当な説明を提供しました(Scott, 1992 )。したがって、Payne ら(Payne, 1998 )は、このような観察された潜伏期間は、特定の空間的位置における典型的なプリオンタンパク質の感染因子タンパク質への変換速度によって説明されるというよりも、むしろ近隣地域間の伝播速度と関連している可能性が高いという仮説を提唱しました。このような仮説を証明するには、NPMの元々の疫学的な構成を拡張し、プリオン動態の時間的進化に空間的な「つながり」の要素を組み込む必要がありました(Stumpf, 2000 )。この拡張モデルの主な前提条件は、感染因子となるタンパク質が軸索輸送によって軸索や樹状突起に沿って空間的に広がっていくというものでした。さらに、細胞から細胞への感染速度は、接続の強さに依存するという前提も自然なものでした。
折り畳み異常タンパク質の力学は、数学的にどのようにモデル化されるのでしょうか?
タンパク質凝集メカニズムのモデル化における化学反応速度論
タンパク質凝集メカニズムのモデル化における最も新しいアプローチは、化学反応速度論の原理を利用して、タンパク質の凝集メカニズムに関与するさまざまな微視的プロセスを明確に説明するマスター方程式を導き出すというものです (Cohen, 2012 ; Cohen, 2013 )。 その目的は、そのようなマスター方程式から導き出される統合速度法によって、タンパク質凝集の速度論を特徴づけることです。
大澤らは、フィラメント状成長現象 を考慮 し、均一核生成、成長、解離のプロセスを基本原理として、タンパク質凝集のマスター方程式モデルの最初の原型を提案しました。NPMの場合と同様に、マスター方程式は無限個の微分方程式(ODE)によって解析的に記述することができます。しかし実際には、このような無限個のODEは、一般的に「モーメント方程式」と呼ばれる2つのODEからなる閉じたシステムに帰着します。この方程式は、タンパク質凝集体の数と質量濃度の時間的変化を特徴づけるもので、これはほとんどの一般的なin vitro実験の測定値に直接関係する量です。そして、モーメント方程式を解くことで、所望の積分速度則を簡単に導くことができます (Cohen, 2013 )。しかし、特に反応の全経過時間に対してモーメント方程式を解析的に解くことは複雑な作業です。
そこで、Knowles 氏ら (Knowles, 2009 )が、反応の全経過に有効な積分速度法則の解析的解を導き出し、タンパク質形成に関するマスター方程式理論に大きな貢献をもたらしました。大澤のオリジナル理論の場合と同様に、これらの明示的な積分速度式は、実験的に観測された現象学的変数と容易に関連付けることができる2つのパラメータに対する反応時間経過の依存性を特徴付けることができます (Cohen, 2011 )。 実用的な観点から、積分速度式の解析式を持つことは極めて重要であり、これにより、異なる実験条件下で得られたデータにモデルを適合させることができます。例えば、Knowles ら (Knowles, 2009 )が提案したモデルは、ペプチド Aß40 および Aß42 に対応するin vitroデータに適合され、Aß凝集体の形成についてより明確な理解をもたらしました (Meisl, 2014 ; Meisl, 2016)。ここ数年、マスター方程式アプローチとそれに対応する統合速度論は、複数の拡張と一般化の対象となってきました。その中でも注目すべきものは、Cohenら (Cohen, 2014 )によるもので、空間伝播のメカニズムをマスター方程式に含めることで、二次凝集経路が拡散による空間伝播の速度を支配することを発見しました。
凝集に関する凝集理論
マスター方程式のアプローチの場合と同様に、Smoluchowskiの方程式で説明される凝集理論も、異なるサイズの粒子集合体における自己会合の一般的なケースをカバーしています。タンパク質の凝集の文脈におけるSmoluchowskiの方程式の最初の言及は、短い線維の末端間凝集による線維の軸方向伸長を説明した Murphy et al. (Murphy, 2000 ) に登場しました。同様に、Smoluchowskiの式を使用して、Craft ら (Craft, 2005 )は、核形成プロセスが小サイズのポリマー(モノマー、ミセル、フィラメントなど)の会合メカニズムに暗黙的に組み込まれている重合モデルを提案しました。
タンパク質の凝集と伝播のメカニズムのモデリングの分野における重要な転換点は、Achdou ら (Achdou, 2013 )によるものです。Achdou ら (Achdou, 2013 )は、モーメント方程式ではなく、無限個の常微分方程式を十分大きな数N で打ち切りました。これにより、打ち切り数 Nに対応する方程式は、N 個以上のモノマーで構成されるすべてのタンパク質集合体の概要の時間発展を記述できるはずです。さらに、Achdou ら (Achdou, 2013 )は、Smoluchowskiの式が空間伝播のプロセスを組み込むためのわかりやすい枠組みも提供していることに気づきました。
現代のイメージング技術の発展により、ミクロなスケールよりも大きなスケールでモデルを調査できる可能性が求められています。この目的のために、Bertsch ら (Bertsch, 2017)は、一連の切断 Smoluchowski 方程式を、プリオン様伝播によるニューロン間の神経損傷の広がりをモデル化する運動型輸送方程式に結合した大規模モデルを提案しました。このようなモデリングでは、同じ空間領域で進化する2つの異なる時間スケールを組み込むことができます。すなわち、微視的プロセス(Smoluchowskiの方程式による)には高速の時間スケール(例えば、分、時間単位)、そして、ヒトにおけるアルツハイマー病の進行(輸送方程式による)には低速の時間スケール(例えば、月、年単位)です。
ネットワークアプローチによる地域間伝播のモデリング
均質拡散プロセスによる折りたたみ異常タンパク質の空間的拡散のモデリングは、脳全体のような広大な空間領域では現実的な選択ではありません。均質拡散による拡散とは対照的に、ネットワークアプローチでは、高度に結合したニューロン群内での感染の急速な拡大と、長距離接続を介した他の群への伝播をモデル化します (Matthäus, 2006 )。したがって、離散的な感受性感染(SI)疫学モデルを使用することで、マテウス氏らは (Matthäus, 2006)は 、相互に接続されたニューロンのネットワークに沿ったプリオンタンパク質感染の拡大を特徴づけました。さらに重要なことは、このネットワークに基づく数学的枠組みは、ネットワークのノードが大きな空間領域をカバーする遠隔地域を表す、より大規模なシナリオを記述するために容易に適応できることです。
この流れの中で、Raj 氏らは (Raj, 2012 )、巨視的なネットワーク拡散モデル(NDM)を提案しました。このモデルでは、任意の脳領域から他の領域へのMP求心性神経線維の数は、両方の領域における病気の濃度因子と、両領域間の解剖学的接続強度にのみ依存します。より現実的なシナリオを考慮し、Iturria-Medina 氏らは (Iturria-Medina, 2014 ) 、MP の生産/除去能力と脳の解剖学的ネットワークのトポロジー情報を同時に考慮する伝染病拡散モデル (ESM) を導入しました。このモデルをアミロイドPETデータを用いた晩発性ADの研究に適用したところ、このモデルは個々のレベルでAβ沈着パターンを再現することができました。AD進行に関する詳細な病理学的メカニズムと仮説の存在は、折り畳み異常タンパク質の形成と伝播を越えた、より統合的な多因子モデリングアプローチの検討を促しました (Edelstein-Keshet, 2002 ; Luca, 2003 )。
治療介入のための理論モデルはどのように利用できるのでしょうか?
通常、タンパク質の凝集に関する数学モデルは、in vitroでの治療介入の代替手段として使用されます。一般的な考え方は、治療介入(例えば、薬剤、抗体、分子シャペロン)が特定の微視的凝集プロセスをどのように阻害するかをシミュレーションすることです(Arosio, 2014 ;Nasica-Labouze, 2015 ;Kulenkampff, 2021 ;Ghosh, 2023 )。次に、タンパク質の凝集の速度論的反応速度を、自然条件下および阻害条件下の両方で推定し、比較することができます。 まず、適切な速度論的反応速度に仮説上の変化(例えば、処理による)を仮定し、その修正された速度を元のモデルに代入して、処理後の状態をシミュレーションします。
仮説上の薬物用量の関数として速度論的反応速度をモニタリングすることで、in vitro環境に固有の少量の薬物用量を、in vivo環境により近い用量に外挿できる可能性があります(Masel, 2000 )。先駆的な研究において、Maselら(Masel, 2000 )は、数学モデルを使用してアミロイド伝播の阻害をシミュレートし、主に以下の3つのアプローチを試みました。(i) 折り畳まれていないタンパク質の有効な単量体濃度を低下させる、(ii) 成長中のポリマー末端を遮断する、(iii) ポリマーの分解率を増加させる、という3つの主なアプローチです。彼らは、2番目の戦略に従う治療法が有望な結果をもたらす可能性があることを見出しました。一方、残りの戦略は効果が期待できないか、あるいは薬物の投与量が少ない場合にはアミロイド形成プロセスを加速させる可能性さえあることが分かりました。
アミロイドの凝集/伝播の阻害を模倣する3つの異なる戦略: (1) 有効な単量体濃度の低下、(2) 成長中のポリマー末端の遮断、(3) ポリマーの分解率の増加。
別の例として、アミロイドベータタンパク質を例にとると、Craft ら(Craft, 2005 )は重合率と総Aβ負荷量との間に非線形関係があることを明らかにしました。重合率は4つの異なる速度論的反応速度に依存するため、この文脈では以下のいくつかの治療戦略を試すことができます。(i) Aβモノマーの生産速度の低下、(ii) 断片化の促進、(iii) クリアランス(すなわち分解)速度の促進、(iv) 伸長速度の低下。上記のシナリオのシミュレーションにより、Craft 氏らは(Craft, 2005 )、クリアランス率増強剤に基づく薬物治療は、ポリマー断片化増強剤に基づくものよりも、Aß 総負荷の低減に効果的である可能性があると結論づけました。
さらに最近では、Arosio ら(Arosio, 2016 )が化学動力学アプローチを用いて、分子シャペロンと異なるタンパク質種間の相互作用をモデル化しました。主な考え 方は、分子シャペロンが特定のタンパク質種に結合することで、どの微視的反応段階(すなわち、一次核形成、伸長、断片化、二次核形成)が乱されるかを特定することでした。Arosio 氏らは、マスター方程式アプローチを使用して、分子シャペロンの異なる濃度の存在下および非存在下における推定の速度定数を比較しました。Aß42タンパク質のケースでは、このような分析により、DNAJB6と呼ばれる分子シャペロンの作用が一次核形成プロセスを阻害することが明らかになりました。一方、別の分子シャペロン(proSP-C Brichosと呼ばれる)の存在は、二次核形成率の低下をもたらします。
さらに、Habchi ら(Habchi, 2016 )は、合理的な創薬戦略を開発するために化学動力学アプローチを使用し、抗がん剤(bexarotene)がAß42凝集の一次核形成段階を妨害し、毒性オリゴマーの形成を遅らせ、Aß42沈着を完全に抑制することを報告しました。この一般的な枠組みは、凝集の開始だけでなく、有毒なAß42オリゴマーの増殖の原因となる二次核生成段階も標的とする、さまざまな低分子(Habchi, 2017 )および抗体(Aprile, 2017 )を特定することを目的とした、系統的な創薬戦略を生み出します。
化学反応速度論とタンパク質凝集の分野における最近の進歩により、MP関連疾患における新たな治療薬の発見に役立つツールとして、治療介入モデリングへの関心が再び高まっていることは間違いありません(Linse, 2020 ;Kulenkampff, 2021 ;Ghosh, 2023 )。
神経疾患におけるタンパク質の異常折りたたみのモデリングに関するご質問や、その他のイメージングサービスに関する具体的な情報提供など、当社のチームが喜んで対応いたします。
当社のイメージングサービスについてさらに詳しく知る
関連コンテンツ
神経疾患の臨床試験における神経画像診断の使用に関するベストプラクティスの最新情報。
ハンチントン病臨床試験におけるPETイメージング
ハンチントン病(HD)の臨床試験におけるPETイメージングバイオマーカーの使用に関する概要。
MCIとアルツハイマー病におけるタウPETの経時的変化
軽度認知障害(MCI)およびアルツハイマー病(AD)におけるタウPETトレーサーの取り込みと結合の変化に関する自然史の概要。
CBDと他のタウオパチーを区別するバイオマーカーのイメージング
脳画像バイオマーカーの概要と、それを用いた大脳皮質基底核変性症(CBD)患者の特定、および疾患修飾療法の臨床試験におけるその使用。
前頭側頭型認知症における神経画像診断と臨床試験
前頭側頭型認知症(FTD)の変異型に対する理解におけるMRIおよびPET画像診断によるバイオマーカーの有用性、およびFTD臨床試験におけるエンドポイントとしてのその使用。