HDの疾患進行を追跡する上で、どのPETバイオマーカーが最も効果的ですか?
ハンチントン病
ハンチントン病(HD)は、常染色体優性遺伝するまれな進行性の神経変性疾患です。 症状は通常35歳から40歳の間で現れますが、まれに若年発症型ハンチントン病(JHD)が20歳前に発症することもあります(Klöppel, 2009)。この病気は、運動機能、認知能力、精神神経の健康状態が徐々に低下していくという特徴があります。ハンチントン病の根本的な原因は、HTT遺伝子における変異であり、CAGリピートの拡大により、有毒な変異型ハンチントンタンパク質(mHTT)が生成されます。CAGリピート数が39を超えると、この疾患が発症し、リピート数が多くなるほど発症が早まり、病気の進行が早くなります(Reiner, 2011;Wijeratne, 2021)。
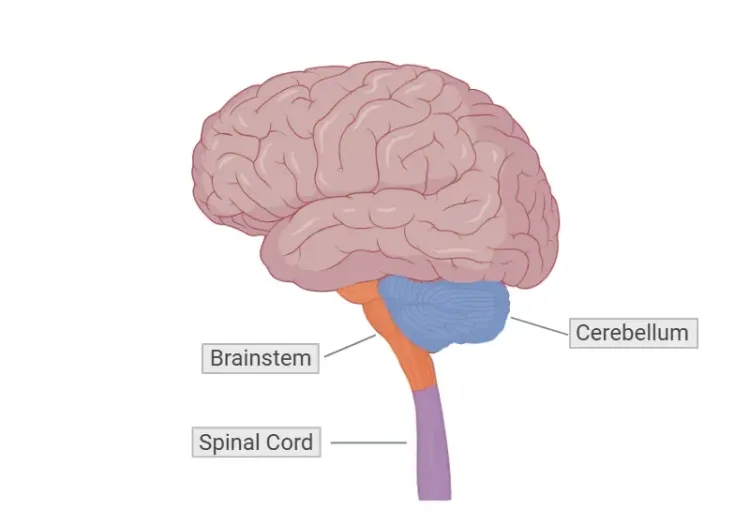
HDの病理学的特徴として、線条体の中核にある中型有棘ニューロン(MSN)の変性があり、これに伴って線条体の萎縮などの構造変化が起こります。神経画像診断、特に磁気共鳴画像法(MRI)や陽電子放射断層撮影(PET)によるスキャンは、運動症状が現れる前に早期の脳の変化を検出できることが多く、病気の進行や早期介入の可能性について重要な洞察を提供します(Klöppel, 2009;Hobbs, 2024)。
現在、病態修飾療法は存在しませんが、進行中の研究では、この疾患の病理学において中心的な役割を果たすmHTT凝集体を標的とする治療法に焦点が当てられています。PET画像診断は、脳内のさまざまな分子および代謝の変化を視覚化することで、疾患の進行をモニタリングするのに役立ちます。これには、グルコース代謝、ドーパミン作動性活性、ホスホジエステラーゼレベル、神経炎症の変化が含まれます(Cybulska, 2020)。さらに、mHTT凝集体の定量化と追跡を目的とした新規PET放射性リガンドの開発が進行中であり、新しい治療アプローチの有効性を評価する上で貴重なツールとなる可能性があります(Fazio, 2018;Cybulska, 2020;Dickmann, 2024)。
脳のグルコース代謝
最も初期のHDのバイオマーカーのひとつは線条体の低代謝であり、[18F]フルオロデオキシグルコース(FDG)PETイメージングで検出できます。この代謝低下は、臨床症状が現れる前に起こることがよくあります。縦断的研究により、線条体、視床、島、後部帯状回、前頭前野、後頭葉皮質など、脳の皮質下および皮質領域の両方でグルコース代謝が徐々に低下することが示されています(Fazio, 2018)。さらに、皮質グルコース代謝の低下は認知障害の悪化と関連しています(Fazio, 2018)。
JHDでは、線条体と嗅内皮質におけるFDG取り込みは成人発症HDと比較して低くなります。逆に、成人発症HD患者では、左下頭頂小葉や左帯状回などの皮質領域でより著しい減少が認められます(Caligiuri, 2024)。縦断的研究では、代謝低下の異なるパターンも明らかになっており、成人発症HDでは皮質FDG取り込みの減少がより一貫して見られるのに対し、JHDではより変動が見られます(Caligiuri, 2024)。興味深いことに、PET研究では、発症前のHD遺伝子保有者において早期の視床の代謝亢進が確認されており、臨床症状が現れると減少する傾向があります(Feigin, 2007)。この初期の視床の代謝亢進は代償メカニズムを反映している可能性もありますが、その正確な役割は依然として不明です(Feigin, 2007;Hellem, 2021)。
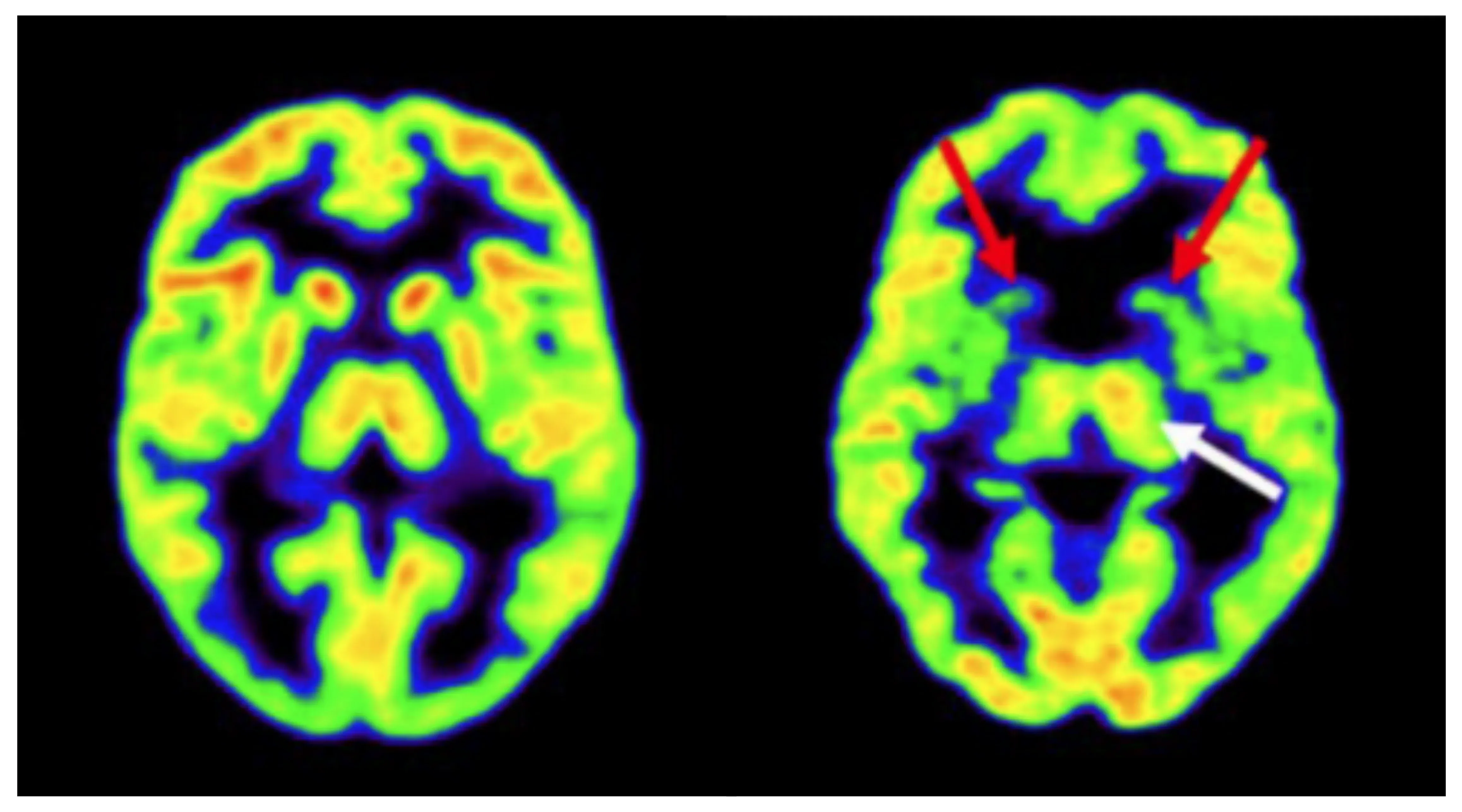
健常対照者(左)と発症前HD遺伝子拡張キャリア(右)のFDG PETスキャン。HD遺伝子拡張キャリアでは、両側線条体の代謝低下(赤矢印)と左視床における代謝の潜在的な代償性増加(白矢印)が認められます。図は、クリエイティブ・コモンズ表示ライセンスに基づき、Hellem et al.(Hellem, 2021) より改変しています。
ドーパミン作動性イメージングマーカー
線条体における中脳被蓋野ニューロンの変性は、HDの決定的な特徴であり、ドーパミン受容体の機能不全につながります。 ドーパミンD1およびD2/3受容体を標的とするトレーサーを用いたPETイメージングは、病気の進行に関する洞察を提供します。例えば、[11C]SCH-23390トレーサーを用いた研究では、顕性HD患者の被殻におけるD1受容体の密度が著しく低下しており、健常対照者と比較して約50%減少していることが示されています(Cybulska, 2020)。縦断的研究により、発症前HDではD1受容体の減少がより緩やかに起こることが示されています。減少率は年間2%と、発症後HD患者の年間5%よりも遅いペースです(Cybulska, 2020)。
同様に、D2/3受容体の定量化のためのPETトレーサーである[11C]ラクロプリドを用いたPET画像では、線条体におけるD2受容体の著しい損失が示されており、これは病期によって異なります。発症前HDでは10~50%の損失が認められるのに対し、発症HDでは40~60%の損失が認められます(Fazio, 2018)。さらに、発症したHDでは、大脳皮質におけるD2/3結合の減少は、神経心理学的検査、特に言語流暢性や記憶力を評価する検査での成績低下と相関しています(Cybulska, 2020)。
[11C]dihydrotetrabenazine(DTBZ)などのシナプス前マーカーを用いたPET画像診断では、顕性HD患者の線条体におけるモノアミン輸送体2(VMAT2)結合の減少が明らかになっています。さらに、[11C]β-CIT PETスキャンでは、線条体におけるドーパミン輸送体(DAT)結合の50%減少が示されており、HD病理におけるドーパミン作動性機能不全の役割をさらに裏付けるものとなっています(Fazio, 2018)。
ホスホジエステラーゼ10A(PDE10A)イメージング
PDE10Aは、[18F]JNJ42249152、[18F]MNI-659、[11C]IMA-107などのリガンドを用いたPETイメージングでモニタリングできる、MSNsに高度に発現する酵素です(Fazio, 2018)。顕性HDでは、PET画像により線条体の結合の著しい減少が明らかになり、これは疾患の重症度と相関しています(Cybulska、2020年)。縦断的研究により、この減少は、健常対照者と比較して、被殻、尾状核、淡蒼球でより顕著であり、年間の低下率が高いことが示されています(Cybulska、2020年)。
興味深いことに、発症前HDでは、運動視床核における結合の増加が観察されており、これは症状が現れるにつれて減少する代償反応を示唆しています(Cybulska, 2020)。これらの早期のPDE10Aの変化は、臨床症状の発症の最大25年前に検出することができ、発症予測バイオマーカーとして役立つ可能性があり、介入の潜在的なターゲットを提供します(Niccolini, 2015)。
神経炎症マーカー
神経炎症もまた、HDのもう一つの特徴であり、ミクログリアの活性化が重要な指標となります。18-kDaトランスロケータータンパク(TSPO)を標的とするトレーサー、例えば[11C]PK11195 を用いたPET画像診断では、発症前および発症後の両方のHDにおいて放射性リガンド結合の増加が示されており、早期のミクログリア活性化がこの疾患の潜在的なバイオマーカーである可能性を示唆しています(Cybulska, 2020)。結合の増加は、線条体、皮質、淡蒼球、島皮質など、運動、認知、精神機能に関与するいくつかの脳領域で観察されています(Cybulska, 2020)。この神経炎症マーカーは、症状の進行リスクのある患者を早期に特定するのに役立つ可能性があり、疾患修飾療法を目的とした臨床試験における患者層別化に有用であることが証明されるかもしれません(Hobbs, 2024)。
全体として、HDは複雑な神経変性疾患であり、神経画像診断の進歩により、その初期段階の進行に関する理解が大幅に深まりました。PET画像診断により、糖代謝、ドーパミン作動性活性、ホスホジエステラーゼ発現、神経炎症に関連する主要なバイオマーカーが明らかになりました。これらの知見は、疾患の進行を追跡するだけでなく、治療介入の潜在的なターゲットを提供することにも役立ちます。
PET画像診断によるバイオマーカーは、従来のHDの臨床結果評価とどのように相関するのでしょうか?
PET画像診断は、臨床結果の測定値と密接に関連し、HDにおける早期の疾患進行を追跡する強力なツールとなります。例えば、発症前のHDにおけるFDG PET画像診断では、線条体の代謝とCAGおよび年齢の積(CAP)スコアとの間に強い負の相関が認められます。この観察結果は、運動症状の発症に近づくにつれ、線条体の代謝活動が低下することを示唆しています(Hellem, 2021)。興味深いことに、線条体の代謝は、MRIによる容積測定よりもCAPスコアの変動をよりよく説明することが判明しており、PETが早期の段階で疾患の進行を追跡する上で高い感度を有していることを示しています(Hellem, 2021)。
線条体の変化に加えて、発症前HDにおける進行性の皮質低代謝は、認知障害の進行と相関することが示されています(Fazio, 2018)。発症前HD保因者の尾状核および被殻における低代謝は、症状の進行リスクが高いことと関連しています(Hobbs, 2024)。横断的データも、発症前キャリアにおける大脳基底核の低代謝と精神運動速度の低下との相関を示唆しています(Hobbs, 2024)。 顕性HDでは、線条体および皮質の低代謝は、いずれも機能的能力、運動機能、言語学習、記憶、および全体的な認知障害と相関しています(Hobbs, 2024)。さらに、発症前および発症段階の両方における大脳皮質の低代謝は、算数的な言葉の問題解決の困難と関連しています。一方、発症初期のHDにおける大脳皮質および辺縁系の代謝ネットワークの変化は、無気力と関連しています。
JHDでは、グルコース代謝の年間変化が大きいほどジストニア、パーキンソン様症状が悪化し、自立度が低下することが分かっています(Caligiuri, 2024)。PET画像診断研究では、発症前HDにおける線条体のD2受容体結合の減少が実行機能障害および言語流暢性の低下と相関していることが示されています。一方、発症前および発症段階の両方におけるPDE10A結合の喪失は運動障害と関連しています(Hobbs, 2024)。
HD臨床試験におけるPETイメージングの今後の方向性はどのようなものでしょうか?
HD研究における最も有望な将来の方向性のひとつは、mHTT凝集体に特異的に結合するPETリガンドの開発です。 これらの放射性リガンドは、mHTTレベルの低減を目的とした臨床試験において重要な役割を果たす可能性があり、研究者はそれによって脳の標的結合を視覚化および定量化し、それにより局所分布に関する洞察を得ることができます(Lieberman, 2022;Hobbs, 2024)。しかし、アルツハイマー病(AD)やパーキンソン病(PD)などの他の神経変性疾患におけるミスフォールドタンパク質と比較すると、mHTT凝集体の存在量が比較的少ないという課題があります(Dickmann, 2024)。この問題を克服するには、TDP-43、α-シヌクレイン、タウ、アミロイドベータなどの他のタンパク質凝集体よりもmHTTに対して非常に選択性の高い高親和性リガンドを開発する必要があります(Dickmann, 2024)。
いくつかの有望なPETリガンドが、mHTTを標的とする能力について試験されています。これには、[11C]CHDI-180R、[11C]CHDI-626、[18F]1、および[18F]CHDI-650が含まれます。 潜在的な可能性にもかかわらず、これらのリガンドの多くはmHTTに対する選択性と親和性が限定的であることが示されており、有効性が不十分であるとして中止されたものもあります(Dickmann, 2024)。この問題に対処するため、生体内でmHTTを確実に標的とすることができる新規PET放射性リガンドの設計と評価に重点を置いた研究が継続されています(NCT06634628)。これらの放射性リガンドの開発に成功すれば、mHTT凝集体の検出とモニタリングのための非侵襲的な方法が提供され、臨床試験とHDの早期診断の両方にとって重要な進歩となります(Kaur, 2021)。
さらに、これらの放射性リガンドは、疾患の進行に関する貴重な洞察をもたらし、臨床試験における患者層別化をより正確に行うことを可能にするかもしれません。また、mHTTを標的とした疾患修飾治療に対する反応を評価する上で重要な役割を果たし、治療効果の改善につながる可能性もあります(Kaur, 2021)。
HDでは、特に線条体におけるmHTTタンパク質の蓄積が神経変性を引き起こし、運動、認知、神経精神障害と関連しています。mHTTに対する高親和性および選択性を有するPETリガンドは現在も開発中ですが、脳内のmHTT蓄積量を客観的に定量化できる可能性を秘めています。これらのツールは、臨床試験におけるmHTTを標的とした新薬の評価や、病気の進行を追跡するための重要なマーカーとなり、それによって診断および治療戦略の両方が進歩する可能性があります。
クリックしてリンクをコピー
当社のチームは、ハンチントン病の臨床試験におけるPETバイオマーカーに関するご質問や、その他のイメージングサービスに関する具体的な情報提供など、どのようなご質問にも喜んでお答えいたします。
当社のイメージングサービスについてさらに詳しく知る
関連コンテンツ
神経疾患の臨床試験における神経画像診断の使用に関するベストプラクティスの最新情報。
脊髄小脳変性症の臨床試験とイメージングバイオマーカー
脊髄小脳変性症の臨床試験における疾患進行のモニタリングのための、構造MRI、DTI、MRSイメージングバイオマーカーの概要。
ハンチントン病の臨床試験におけるMRIバイオマーカー
ハンチントン病(HD)の臨床試験における構造的および拡散MRI画像のバイオマーカーの使用に関する概要。
結節性硬化症(TSC)の神経画像バイオマーカー
TSCの臨床試験における疾患修飾治療薬の効果をモニタリングするための、脳構造MRIおよび拡散強調画像バイオマーカーの概要。
神経疾患におけるタンパク質の異常折りたたみのモデリング
神経変性におけるタンパク質のミスフォールディングのメカニズムの計算モデル化と、疾患修飾治療薬の発見と開発への応用。
フリードライヒ失調症の臨床試験におけるバイオマーカーのイメージング
フリードライヒ失調症(FRDA)の研究調査および多施設臨床試験におけるMRIおよびDTIイメージングバイオマーカーの使用に関する概要。
多系統萎縮症(MSA)の臨床試験におけるMRI
この資料では、MSAの研究におけるバイオマーカーとしての体積MRIと拡散強調画像(DWI)の有用性について概説しています。