この資料では、以下の内容について説明しています。
HDの臨床症状と遺伝的背景はどのようなものですか?
臨床症状
ハンチントン病(HD)は、常染色体優性遺伝するまれな進行性の神経変性疾患で、通常は35歳から40歳の間で成人期に発症する症状が現れます。 その発症率は、ヨーロッパ系の人々では10万人あたり約4~10人です(Klöppel, 2009)。主に線条体の中間棘細胞(MSNs)の変性によって特徴づけられます。神経画像研究では、臨床症状が現れる何年も前から、尾状核と被殻の早期萎縮と大脳白質の徐々に進行する損失が明らかになっています。 病気が進行すると、運動制御、認知機能、神経精神衛生が徐々に低下します。
HDの運動症状には、不随意運動と随意運動の両方の困難が伴います。不随意運動には、舞踏病(不規則でぎこちない動き)、ジストニア(筋肉の収縮)、硬直などがあります。随意運動の制御も低下し、構音障害(発話困難)、嚥下障害(嚥下困難)、運動不能(運動を開始する能力の低下)などの症状が現れます(Jiang, 2023)。認知機能の低下は、実行機能の欠損、特に目標指向行動の困難さによって顕著になり、言語学習、視空間能力の障害、最終的には重度の記憶喪失を伴います。神経精神症状も一般的であり、不安、過敏性、うつ病、強迫性障害、攻撃性、無気力、精神病などが含まれます(Jiang, 2023)。さらに、HD患者は意図しない体重減少、睡眠障害、概日リズムの乱れを経験することがよくあります。
ハンチントン病の典型的な発症は35歳から40歳の間ですが、約5%の症例は若年性ハンチントン病(JHD)として20歳前に発症します。この病気は一般的に3つの段階に分けられます。第1段階は、無症状期(または前駆期)として知られ、目立った臨床的異常が認められないことが特徴です。次の段階は前駆期で、運動機能、認知、行動に微妙な変化が現れ始めます。最終段階は顕性期で、症状が顕著になり、ハンチントン病の正式な診断が下されます(Jiang, 2023)。
HDの診断には、遺伝子検査、家族歴の評価、臨床評価を組み合わせた方法が用いられます。運動症状の評価には、統一ハンチントン病評価尺度(UHDRS)が頻繁に使用され、磁気共鳴画像法(MRI)などの神経画像法は、他の疾患の除外や病気の進行のモニタリングに役立ちます。神経画像診断の重要な所見のひとつは尾状核の萎縮であり、これは特に病気の進行を追跡するのに感度が高く、新しい治療法を評価する臨床試験における重要なバイオマーカーとなっています(Hobbs, 2024)。
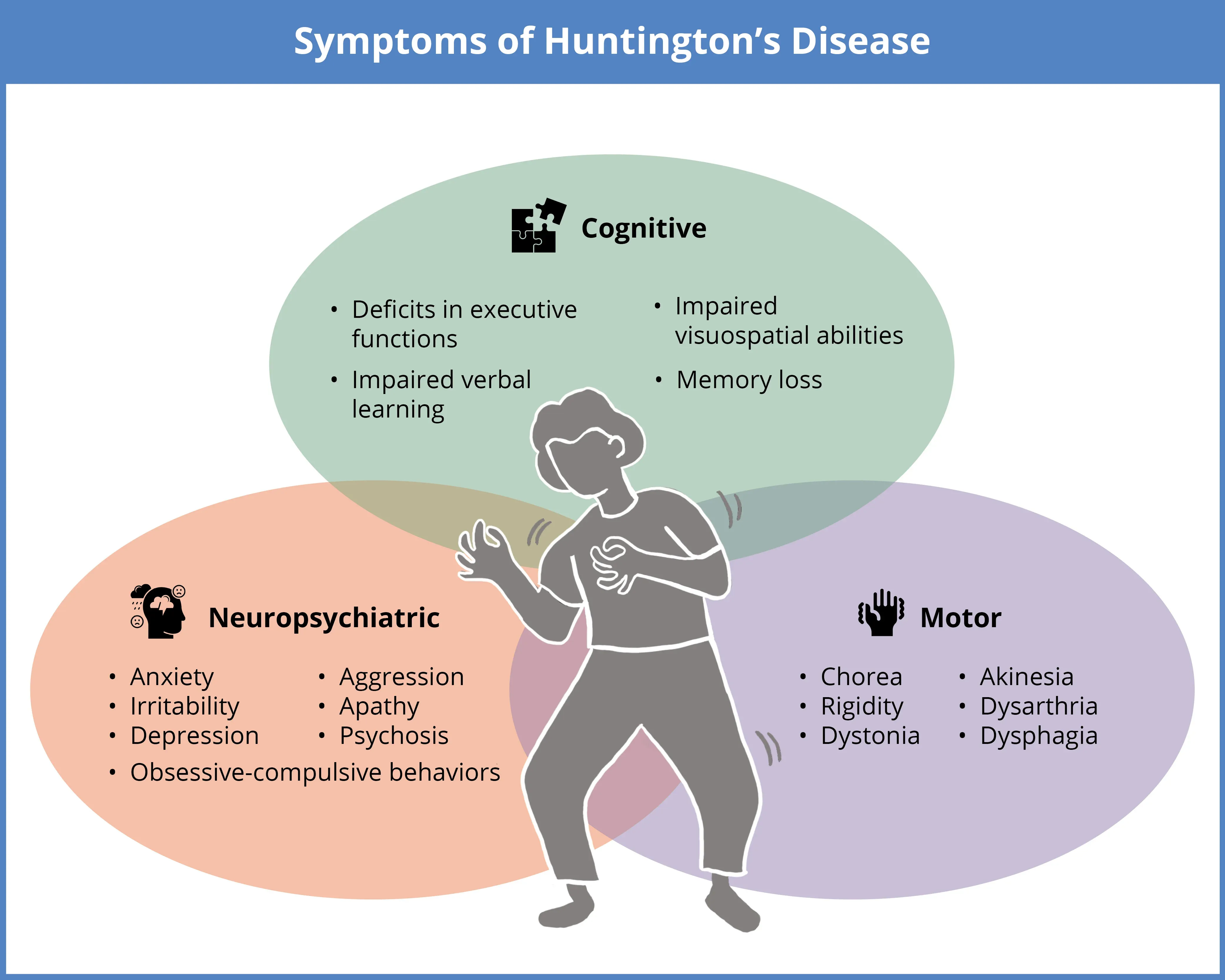
ハンチントン病(HD)は、認知機能の低下(実行機能障害、言語学習および視空間能力の障害、記憶喪失)、神経精神医学的変化(不安、焦燥感、うつ病、強迫性障害、攻撃性、無気力、精神病)、運動機能障害(舞踏病、硬直、ジストニア、無動、構音障害、嚥下障害)などがあります。
クリックしてリンクをコピー
遺伝的基礎
HDは、ハンチントンタンパク質をコードするHTT遺伝子の変異によって生じます。この変異は、第4染色体 上のHTT遺伝子の最初のエクソン内のCAGトリヌクレオチドリピートの異常な拡大から構成されています。正常な遺伝子には10~35回の反復が見られますが、HDでは反復回数が臨界値を超え、変異型ハンチントイン(mHTT)と呼ばれる有毒なハンチントインタンパク質が生成されます(Reiner, 2011)。mHTTの蓄積は細胞機能を混乱させ、神経細胞の損傷につながります。CAGリピートの拡大が大きいほど、発症が早く進行も速いことが分かっており、39回を超えるものは完全に浸透していると考えられています(Reiner, 2011;Wijeratne, 2021)。JHDは、60を超えるCAGリピート伸長と関連していることが多く、硬直、発作、行動変化などの症状が典型的ですが、成人発症HDでは舞踏病がより一般的です(Reiner, 2011)。HDは、脊髄小脳失調症を含むポリグルタミンリピート伸長を伴うより広範な疾患群の一部です。
CAGおよび年齢産物(CAP)スコアは、mHTT曝露の重症度を評価する重要なツールであり、剖検時に観察される病理を予測することができます。このスコアリングシステムは、疾患の進行を予測するのに役立ち、臨床結果との相関関係があることが示されています(Zhang, 2011)。
HTT遺伝子変異の発見により、HDは、遺伝子検査による予測が可能な数少ない神経変性疾患のひとつとなりました。この検査により、HDの家族歴を持つ個人は、遺伝子変異の保有者であるか、あるいは発症前段階のHDであるかを判断することができます(Andica, 2020)。HD遺伝子変異保有者を早期に特定できることは、潜在的な予防的治療を含む疾患修飾療法に焦点を当てた臨床試験に参加できる機会など、大きな利益をもたらします。
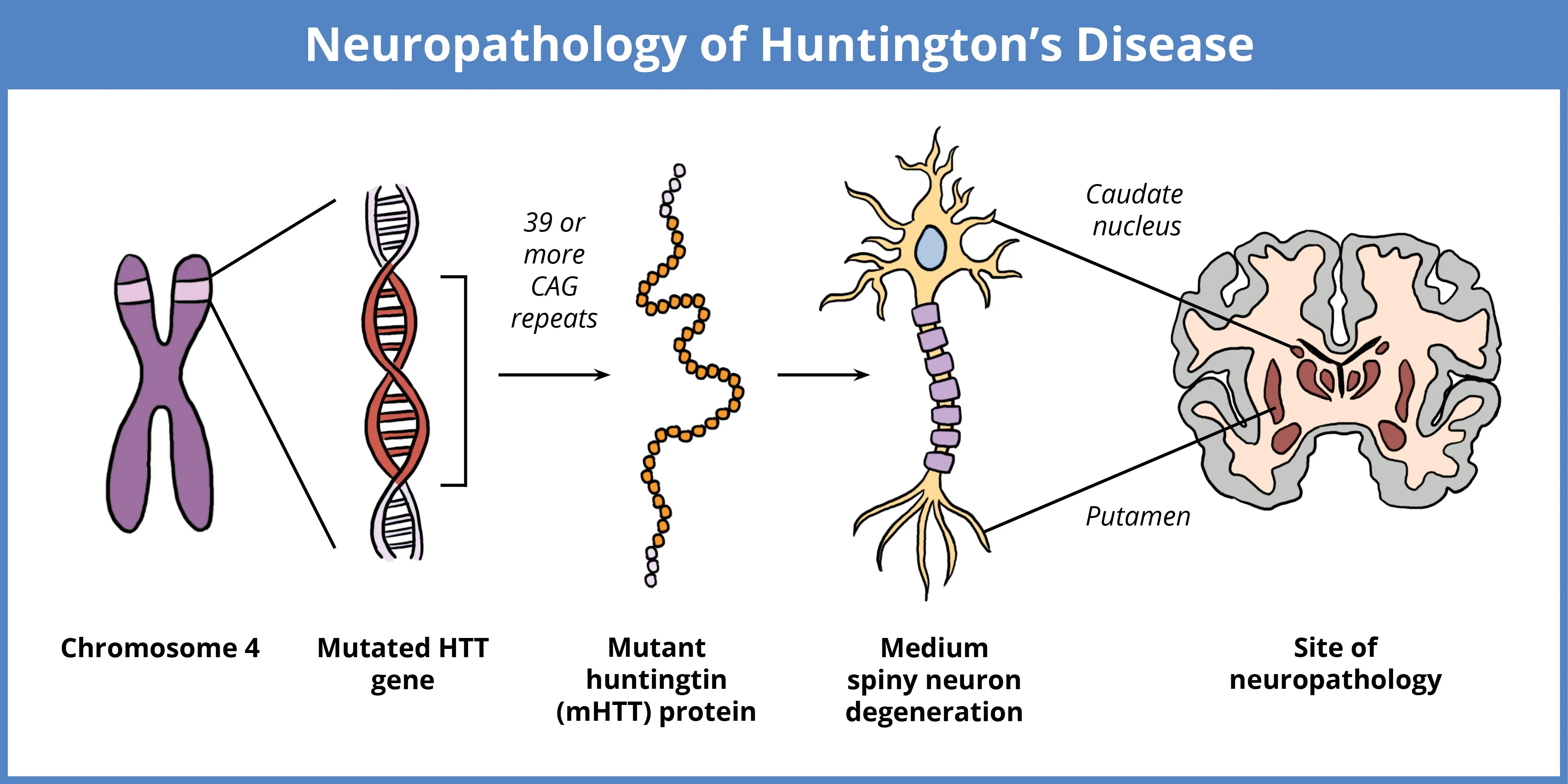
HDは、4番染色体上のHTT遺伝子における変異が原因で起こり、CAGリピートの拡大が特徴です。正常な個体では10~35回の反復が見られますが、39回を超える反復の拡大は、有毒変異型ハンチントンタンパク質(mHTT)の生成につながります。反復回数が大きいほど、発症が早くなります。mHTTの蓄積、特に線条体の中型有棘ニューロン(MSNs)における蓄積は神経変性を引き起こし、運動、認知、神経精神症状をもたらします。
HDの臨床症状は大きく異なり、発症年齢、症状の現れ方、疾患の進行、CAGリピート長の違いが、この疾患の複雑さに寄与しています(Cao, 2024)。この多様性は、早期診断を可能にし、治療結果を正確かつ効果的に評価する手段を提供するための信頼性の高いバイオマーカーの必要性を強調しています。臨床試験では、複数のバイオマーカーからのデータを統合することは、参加者を確実にサブグループに層別化し、治療アプローチの精度を高めるために極めて重要です(Wijeratne、2018年)。
HDにおける疾患進行の追跡に有効なMRIバイオマーカーはどれですか?
HDにおける神経病理学的変化は、尾状核や被殻を含む線条体で最も顕著です。主な病理学的特徴は、運動制御と認知機能に重要なGABA作動性MSNsの変性です。HDが進行すると、神経変性は大脳皮質にも影響を及ぼします。構造MRIと拡散MRIの両方の研究により、臨床症状が現れるかなり前から脳の異常が検出できることが示されています。例えば、構造MRIでは線条体の萎縮などの早期の変化が明らかになります。一方、拡散MRIでは特定の白質線維における微細構造の変化が検出されます(Reiner, 2011;Estevez-Fraga, 2023)。これらの画像化技術は、HDの早期発見に重要な役割を果たし、病気の進行に関する重要な洞察を提供します。
構造MRIバイオマーカー
容積MRIは、HDの進行をモニタリングするための重要なツールです。線条体の萎縮は、CAGリピート長および臨床症状が現れる年齢と強い相関があるため(Fazio, 2018; Kinnunen, 2021)、最も信頼性が高く感度の高いバイオマーカーの1つと考えられています。研究により、線条体の萎縮は運動症状の発症の最大23年前に検出できることが示されており、これは治療介入の評価を目的とした疾患モニタリングおよび臨床試験の両方にとって貴重なバイオマーカーとなります(Klöppel, 2009;Hobbs, 2024)。尾状核および被殻の早期萎縮は、画像バイオマーカーの中でも最大級の効果量と関連しています(Hobbs, 2015)。脳容積バイオマーカーを使用して疾患の進行を調査した研究では、プタミンと尾状核が最初に萎縮を示す部位であることが確認されています(Wijeratne, 2018)。HDが進行すると、萎縮は他の脳領域にも広がります。特に後頭葉、運動、背内側前頭前野、頭頂葉皮質などの領域における皮質の薄化は、運動症状の発症に先立って起こることがよくあります (Kinnunen, 2021)。さらに、大脳白質体積は発症初期から減少し始め、病気の進行とともに悪化し続けます (Kinnunen, 2021)。一方、視床や海馬などの領域における萎縮はあまり顕著ではありません(Fazio, 2018)。
拡散MRIバイオマーカー
拡散強調画像(DWI)は、HDにおける早期の微小構造変化を検出するのに特に有用です。縦断的研究では、発症前HDにおける左上縦束線などの特定の白質線維における異方性分率(FA)の減少が示されています(Estevez-Fraga, 2023)。さらに、運動症状の発症の数年前から、脳梁のFAの減少が観察されることがあり、HDの早期バイオマーカーとしての拡散MRIの可能性が強調されています(Hobbs, 2012;Fazio, 2018)。これらのFAの減少は、上縦束、脳梁の小脳、放線冠、および外被殻における平均拡散性(MD)の増加を伴い、HDにおける白質変性の特定のパターンを示唆しています(Estevez-Fraga, 2023)。発症前のHD遺伝子変異キャリアでは、大脳基底核および視床内でもMDの増加が観察されています(Fazio, 2018)。疾患が発症段階まで進行すると、患者はより広範囲にわたる変性を示し、脳深部および表層の脳構造の両方で、FAの大幅な減少とMDの増加が観察されます(Estevez-Fraga, 2020)。縦断的拡散研究では、脳梁、放線冠、脳弓、前頭皮質下白質、および外側被殻においてMD、軸方向拡散性(AD)、放射方向拡散性(RD)の増加が示されています(Estevez-Fraga, 2023)。興味深いことに、一部の研究では、灰白質構造内の拡散指標において一貫性のない結果が報告されているほか、線条体の領域においてFAとMDの両方が予想外に増加していることが報告されています。これはさらなる調査を要する結果です(Klöppel, 2009;Hobbs, 2012;Fazio, 2018;Hobbs, 2024)。
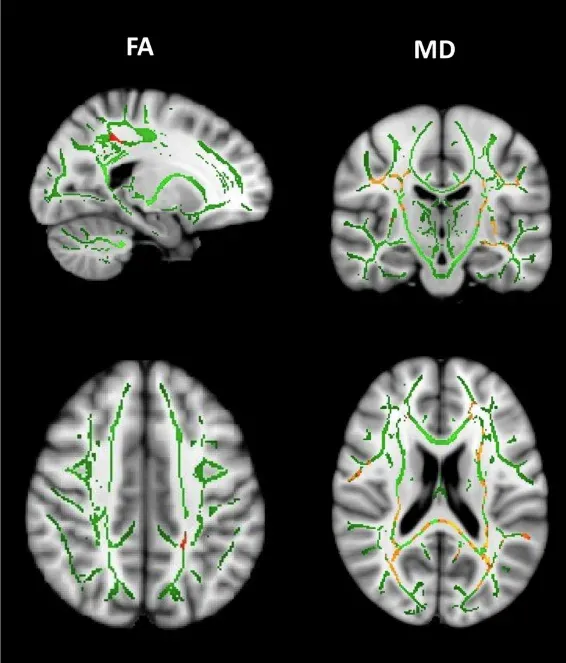
発症前HD遺伝子変異保有者と健常対照者との間における、縦断的な異方性(FA)の減少と平均拡散率(MD)の増加。 発症前HD遺伝子変異保有者では、時間の経過とともに左上縦束においてFAの著しい減少が認められます。 さらに、上縦束、脳梁膨大、放線冠、外側被蓋体を含む領域において、広範囲にわたるMDの増加が観察されます。図は、Estevez-Fraga et al. (Estevez-Fraga, 2023) より クリエイティブ・コモンズ表示ライセンスに基づき転載。
全体として、構造的および拡散MRIバイオマーカーは、線条体の萎縮や特定の白質束における拡散性の増加といった早期指標により早期発見を可能にするなど、HDの進行に関する重要な洞察を提供します。これらのバイオマーカーは、疾患の進行を監視するだけでなく、臨床試験における新治療法の有効性を評価する上で不可欠なツールを提供します。病期に応じてサブグループを層別化することを可能にするこれらのバイオマーカーは、病気のさまざまな段階における治療効果の評価に不可欠です(Klöppel, 2009)。 観察された脳構造および微小構造の変化は、HDの複雑かつ進行性の性質を反映しており、早期診断、介入、治療効果の評価を促進する信頼性の高いバイオマーカーの必要性を強調しています。
HDにおけるMRIバイオマーカーと臨床結果との相関関係はどのようになっているのでしょうか?
CAGリピートの伸長が見られる人々では、特に尾状核と被殻における脳の局所体積が、正式なHD診断を受ける前から、微妙な運動および認知障害と強く相関しています (Kinnunen, 2021)。この集団では早期の障害を検出する臨床尺度の感度が低下しているにもかかわらず、この観察結果は真実です。バイオマーカーの変化を追跡する研究では、臨床および認知バイオマーカーの変化に先立って、特に尾状核と被殻の容積の減少を伴う皮質下の萎縮が起こることが示されています(Wijeratne, 2021)。
HDと診断された患者では、体積MRIと全脳ボクセルベース形態計測(VBM)の結果は、特に尾状核において、運動機能と認知機能の両方と相関しています (Kinnunen, 2021)。これらの相関関係は、おそらく運動制御と認知におけるこれらの脳領域の特殊な機能を反映していると考えられます。さらに、尾状核や被殻を含む線条体の容積は、年齢やCAGリピート長といった従来のマーカーを上回る、疾患進行の予測情報を提供します (Kinnunen, 2021)。
縦断的研究では、尾状核および被殻の容積の変化は、運動または認知評価で観察される臨床的変化よりも顕著であることが多くあります。 疾患進行の最も優れた予測因子を調査した研究では、CAPスコアで定義された異なる進行グループ間の変化を追跡する上で、尾状核および被殻の容積が最も信頼性の高い指標であることが確認されました(Abeyasinghe, 2021)。注目すべきことに、運動、機能、認知のマーカーを追加しても、疾患進行の予測精度は大幅に改善されませんでした。これらの知見は、尾状核および被殻容積のような客観的な神経画像バイオマーカーが、主観的な臨床評価よりも疾患のステージを区別するのに有効であることを示唆しています(Abeyasinghe, 2021)。
さらに、研究により、線条体皮質経路内の拡散性の変化、特に被殻と前頭前野および一次運動野を結ぶ経路の変化は、HD遺伝子変異保有者の運動症状と密接な相関関係があることが示されています(Estevez-Fraga, 2020)。拡散テンソル画像(DTI)を用いて測定した白質完全性の経時的変化も、臨床尺度で測定した運動症状の悪化と相関することが示されています。これは、発症前のHD遺伝子変異保有者でも同様です(Estevez-Fraga, 2023)。これらの知見は、早期の神経画像変化が、将来の病気の経過を予測する上で重要な役割を果たすことを示しています。
まとめると、神経画像バイオマーカー、特に構造MRIと拡散MRIは、HDの早期発見とモニタリングに重要な洞察をもたらします。線条体の容積と白質の完全性の両方は、発症前段階においても、病気の進行を予測する貴重なマーカーとなります。これらの客観的な画像測定は、早期の病変の追跡において、従来の臨床尺度よりも信頼性が高いものです。したがって、MRIバイオマーカーは、臨床試験における治療効果の評価に不可欠なツールであり、病気の進行と治療効果をより正確に追跡することを可能にします。
当社のチームは、ハンチントン病の臨床試験におけるMRIバイオマーカーに関するご質問や、当社のその他のイメージングサービスに関する具体的な情報提供など、どのようなご質問にも喜んでお答えいたします。
当社のイメージングサービスについてさらに詳しく知る
関連コンテンツ
神経疾患の臨床試験における神経画像診断の使用に関するベストプラクティスの最新情報。
脊髄小脳変性症の臨床試験とイメージングバイオマーカー
脊髄小脳変性症の臨床試験における疾患進行のモニタリングのための、構造MRI、DTI、MRSイメージングバイオマーカーの概要。
ハンチントン病臨床試験におけるPETイメージング
ハンチントン病(HD)の臨床試験におけるPETイメージングバイオマーカーの使用に関する概要。
フリードライヒ失調症の臨床試験におけるバイオマーカーのイメージング
フリードライヒ失調症(FRDA)の研究調査および多施設臨床試験におけるMRIおよびDTIイメージングバイオマーカーの使用に関する概要。
多系統萎縮症(MSA)の臨床試験におけるMRI
この資料では、MSAの研究におけるバイオマーカーとしての体積MRIと拡散強調画像(DWI)の有用性について概説しています。