この資料では、以下の内容について説明しています。
FRDAの臨床的特徴と遺伝的背景はどのようなものでしょうか?
臨床的特徴
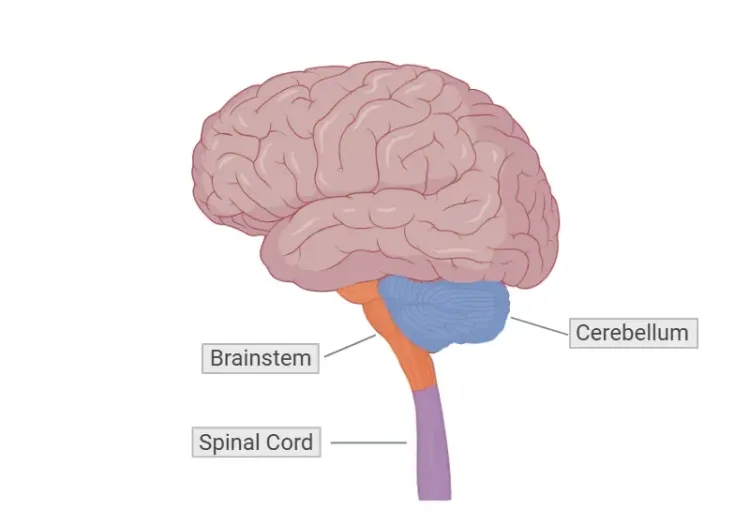
フリードライヒ失調症(FRDA)は、脊髄、小脳、脳幹に主に影響を及ぼす進行性の四肢および歩行失調を特徴とする、まれな常染色体劣性遺伝の神経変性疾患です。FRDAは、常染色体劣性運動失調の中で最も一般的な疾患であり、およそ4万人に1人の割合で発症し、主に西ヨーロッパおよび南ヨーロッパ系の家系に影響を与えています(Vankan, 2013)。この疾患は通常、小児期または思春期に発症し、10歳から15歳の間で発症することが多いですが、10歳未満で症状が現れる子供もいます(Bidichandani, 1998;Mahale, 2024)。あまり一般的ではない症状として、25歳以降に発症する遅発性フリードライヒ失調症(LOFA)と、40歳以降に発症する超遅発性フリードライヒ失調症(VLOFA)があります(Bidichandani, 1998)。男性と女性は同程度に罹患します。
FRDAの臨床的特徴には、進行性の四肢および歩行失調、協調運動の喪失、構音障害などがあり、これらはすべて主に脳や脊髄に関わる神経学的症状です。その他の神経学的症状には、異常な眼球運動、難聴、振戦などがあります(Pandolfo, 2009)。側弯症はよく見られ、FRDA患者の相当な割合に影響を与えており、筋力低下や失調と関連していることから骨格の症状と考えられています。糖尿病はあまり一般的ではありませんが、膵臓の障害によって発症することがよくあります(Bidichandani, 1998)。心臓の障害、特に心筋症は、この病気の深刻な症状であり、早死につながることもよくあります。この病気の経過は、一般的に徐々に運動能力が低下していくもので、ほとんどの患者は症状が現れてから約10年後に車椅子の補助が必要になります(Pandolfo, 2009)。
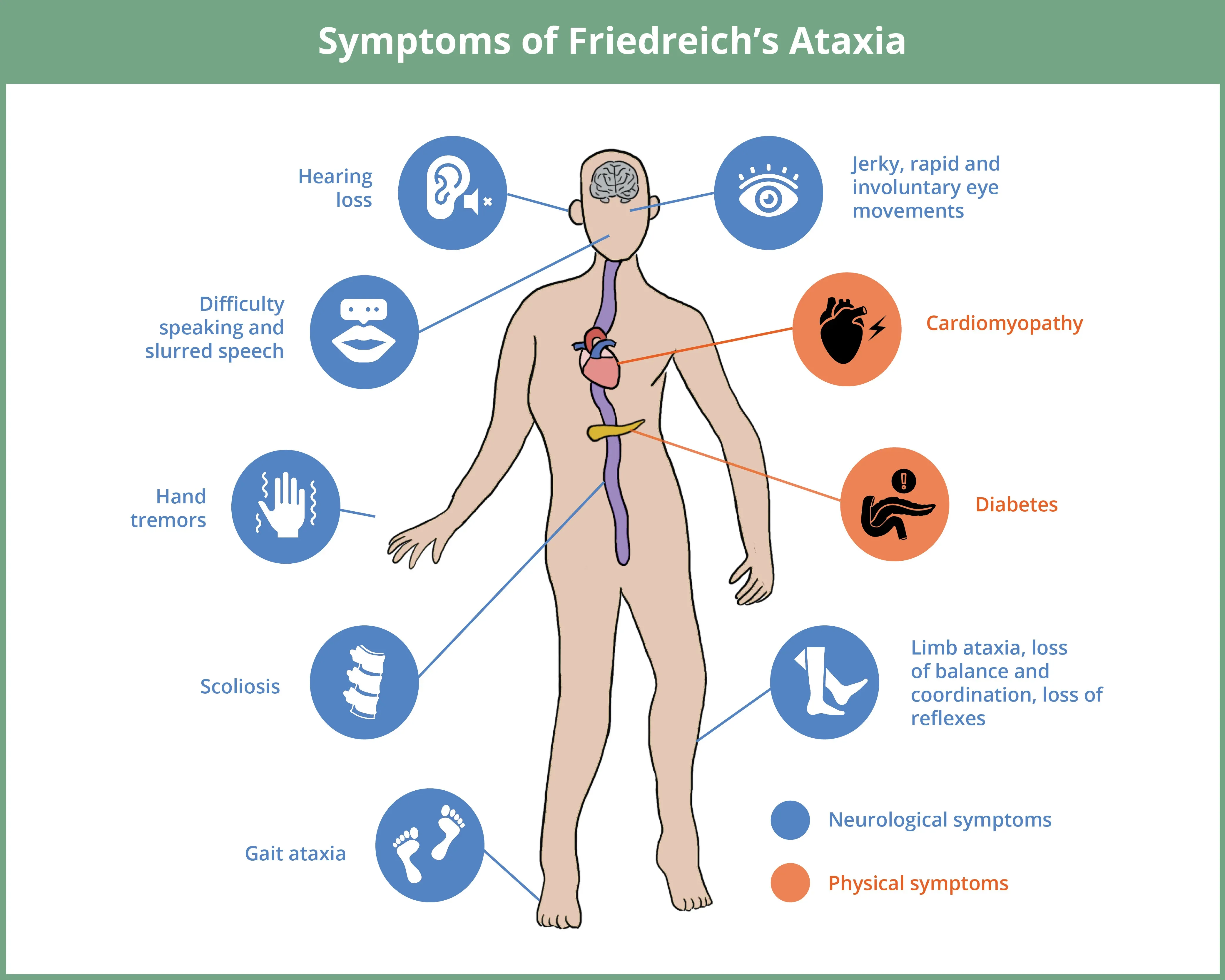
フリードライヒ失調症(FRDA)は、小児期または青年期に発症するまれな神経変性疾患で、主に脊髄、小脳、脳幹に影響を与え、さまざまな神経学的および身体的症状を引き起こします。
クリックしてリンクをコピー
遺伝的背景
FRDAは、第9染色体にあるFXN遺伝子の突然変異によって引き起こされます。最も一般的な突然変異は、FXN遺伝子のイントロン1におけるGAAトリヌクレオチドの反復配列の拡大であり、フラジェニンのタンパク質の産生低下につながります(Koeppen、2011年)。フラタキシンはミトコンドリア機能、特に鉄の制御において重要な役割を果たしており、その欠乏は酸化ストレスと細胞代謝の混乱を引き起こします(Dong, 2024)。FRDAの症例の約96%は、FXN遺伝子の両対立遺伝子におけるGAAリピート伸長が原因であり、フラタキシンのレベルが著しく低下します(Bidichandani, 1998)。研究により、GAAリピート伸長の長さが発症年齢の早期化と重症化の両方と相関することが示されています(Pandolfo, 2009;Koeppen, 2011)。
FXN 変異のヘテロ接合性キャリアはフラタキシン値が低下しますが、FRDA の症状は示しません。 症例のより小さなサブセット(約 4%)では、一方の対立遺伝子に GAA リピート拡張が、もう一方の対立遺伝子に欠失や点変異などの異なる変異が認められます(Bidichandani, 1998)。 これらの症例では、2つの拡張対立遺伝子を持つ症例と比較して、臨床症状が軽度である傾向があります。
診断
FRDAの診断は、主に臨床評価に基づいて行われます。臨床評価には、運動失調、平衡感覚障害、筋力低下、その他の神経障害の徴候を評価するための身体検査が含まれます(Bidichandani, 1998)。FXN遺伝子における突然変異を特定する遺伝子検査は、診断の確定に用いられます。一方、心臓への影響の評価には心エコー検査が役立ちます。また、脳や脊髄の磁気共鳴画像法(MRI)スキャンなどの神経画像技術は、構造変化の評価に用いられます(Bidichandani, 1998)。
FRDAの臨床症状が深刻かつ複雑であることを踏まえると、治療介入に関する継続的な研究が必要です。同様に重要なのは、早期の疾患発見を可能にする信頼性の高いバイオマーカーの開発であり、それにより、タイムリーな介入が可能になります。また、臨床試験における疾患の進行状況の追跡や治療効果の評価には、画像マーカーを含むバイオマーカーの進歩も不可欠です。
FRDAの現在の臨床試験における治療目標は何ですか?
現在のFRDAの臨床試験では、ミトコンドリア機能の改善、酸化ストレスの低減、フラタキシン制御代謝経路の調節に重点が置かれています。その他の主な調査分野には、フラタキシン置換療法や遺伝子置換アプローチなどがあります。
バイオジェン社が開発したオマレロキソロン(SKYCLARYS®)は、2023年2月にFDAの承認を受け、2024年2月には欧州委員会の承認を受けた、FRDAの治療薬として唯一FDAに承認された治療薬です(Pilotto, 2024)。他の複数の企業や研究機関も、追加の治療法の臨床試験を進めています。特に、PTCセラピューティクスは、バチキノン(NCT05515536)の第3相試験を実施しています(Lee、2024年)。フィラデルフィア小児病院とステルス・バイオセラピューティクスが開発したエラミプリチドの第1/2相試験も進行中です(NCT05168774)。 ジメチルフマレートはイタリアで第2相試験が行われています(EUTC: 2022-503016-16-00)。ラリマー・セラピューティクスは、フラタキシン補充療法であるナムラボフスプの第1相試験(NCT06681766)および第2相試験(NCT06447025)(クレイトン、2024年)の両方で研究を進めています。遺伝子置換療法は現在研究段階にあり、Lexeo Therapeutics社とコーネル大学が共同で実施しているLX2006は第1/2相試験(NCT05445323)中です。
さらに、フリードライヒ失調症研究同盟(FARA)は、FRDAにおける神経画像バイオマーカーを調査する大規模な自然史研究、TRACK-FA(NCT04349514)を開始しました(Georgiou-Karistianis、2022)。この研究には、7つの国際的な拠点から200人以上のFRDA患者が参加し、MRI、拡散テンソル画像(DTI)、磁気共鳴スペクトロスコピー(MRS)を用いて、歯状核、小脳、上小脳脚、脊髄などの主要な関心領域における経時的な変化を、ベースライン、12ヶ月、24ヶ月で調査します。この研究の目的は、疾患の進行を追跡し、臨床試験における信頼性の高いエンドポイントとして役立つ画像バイオマーカーを特定することです。
FRDAにおける疾患進行の検出と追跡に有効なMRIおよびDTIバイオマーカーはどれですか?
FRDAは主に小脳、脊髄、脳幹に影響を及ぼし、歯状核、後根神経節、脊髄小脳路および皮質脊髄路に著しい神経病理学的変化が認められます(Harding, 2021)。また、脳の白質の広範囲にわたる損失も観察されています(Harding, 2021)。これらの病理学的変化は、異常な発育と進行性の変性の両方によって生じると考えられています(Rezende, 2023)。
MRIは、FRDAにおける疾患進行の追跡において重要な画像診断技術です。MRIでは、歯状核を含む小脳白質の容積減少が示されるほか、視床、橋、延髄、中脳、上小脳脚などの他の領域でも容積減少が示されます(Adanyeguh, 2023)。縦断的MRI研究では、特に小脳、視床、腹側間脳、橋、中脳における進行性の萎縮が示されています(Adanyeguh, 2023)。これに対し、第四脳室はこれらの領域が萎縮するにつれて容積が増加することが示されています。
DTIでは、特に小脳と皮質脊髄路における微細構造の変化が明らかになっています(Adanyeguh, 2023)。縦断的DTI分析では、上小脳脚における異方性分画(FA)の減少と放射状拡散性(RD)の増加、および下小脳脚におけるRDの年次増加が示されています(Adanyeguh, 2023)。また、歯状回-視床-皮質路(DTT)の変性も観察されており、FAの減少、平均拡散性(MD)および半径方向拡散(RD)の増加、GAAリピートの長さとDTI測定値の間に有意な相関関係が認められ、より長いリピートはより重度の変性と関連していることが示されています(Cocozza, 2024)。
MRSは、FRDA患者の小脳および脊髄における神経化学的変化を検出するために用いられてきました。MRS研究により、小脳における総N-アセチルアスパラギン酸(tNAA)の低下やミオイノシトール(mIns)の上昇といった代謝物の変化が明らかになりましたが、これは従来の画像診断では見られないものでした(Iltis, 2010)。脊髄の研究では、FRDA患者ではtNAAが低く、mInsが高いことが示され、対照群と比較してtNAA/mIns比が減少しました(Joers, 2022)。縦断的データでも、この比率が年間5.8%ずつ減少していることが示されました。これらの結果を総合すると、FRDA患者の脳と脊髄では神経細胞の損失、グリオーシス、異常なミエリン化が起こっていることが示唆されます(Iltis, 2010;Joers, 2022)。
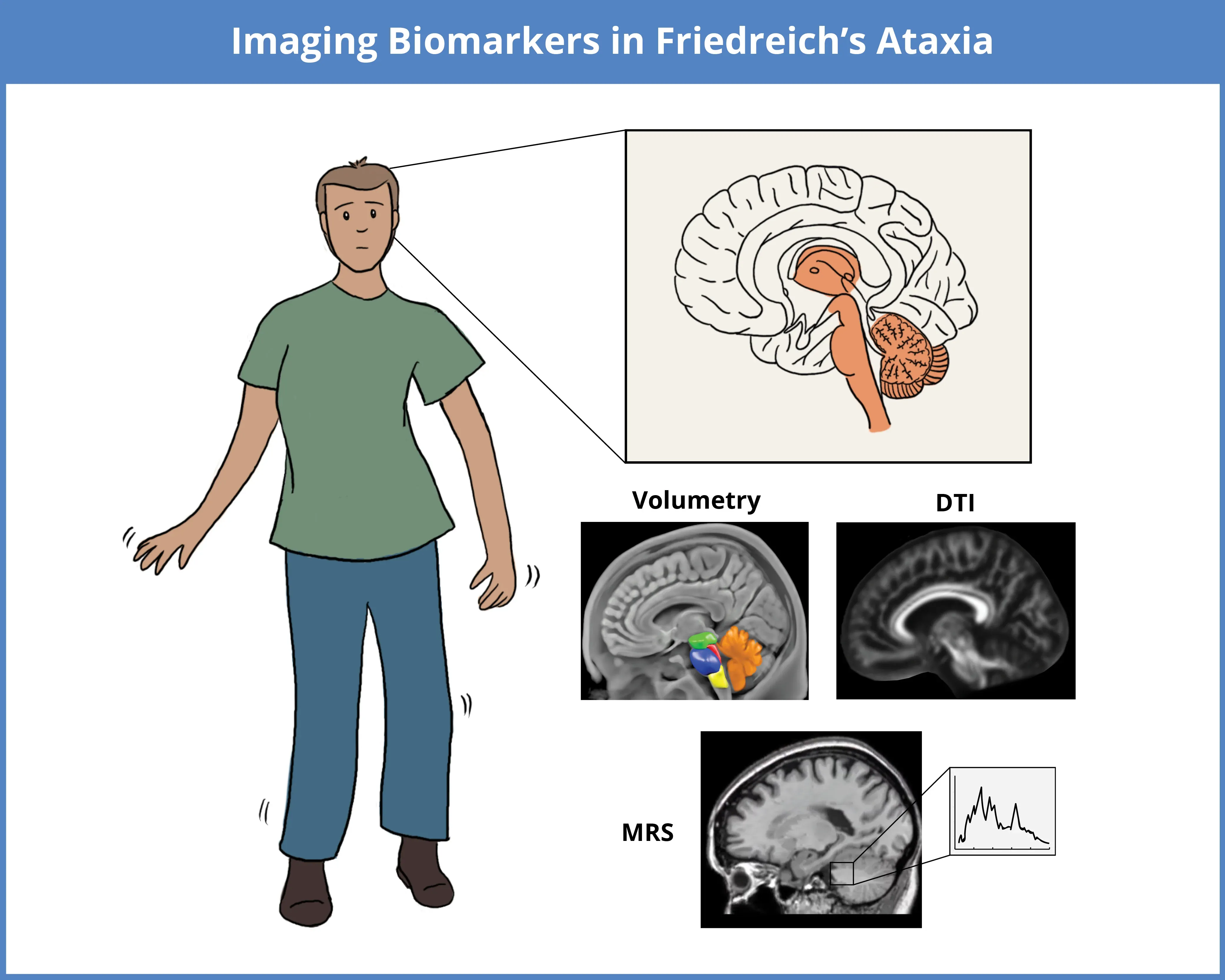
FRDAの評価に使用されるイメージングバイオマーカーには、局所萎縮のMRIベースの構造体積測定、微細構造変化のDTI、神経化学的変化のMRSなどがあります。これらの技術は、特に小脳、脳幹、視床、中脳、脊髄における疾患関連の変化を検出します。
MRI研究では、FRDAにおける神経病理学の程度は病期によって異なることが示されています(Harding, 2021)。容積測定MRIデータは、歯状核と脳幹の変化が発症早期に起こり、大脳灰白質の変性が後期に顕著になることを示唆しています(Harding, 2021)。この容積測定MRIデータは、運動障害が早期に優勢となり、認知、視覚、聴覚の症状が後になって現れる可能性があるというFRDAの臨床的特徴と一致しています。 疾患の進行はGAAリピート長に影響を受け、リピート長が長いほど発症が早く、より重症化しやすいことが分かっています。容積測定研究では、発症年齢が早いほど小脳の白質容積が減少することが示されています。一方、小脳と脳幹の両方の容積減少は、罹病期間と重症度と負の相関関係にあることが示されています(Harding, 2021)。
まとめると、MRIとDTIは、FRDAにおける疾患の進行を検出および追跡するために使用される主な画像診断法です。これらの技術は、歯状核や脊髄などの主要な関心領域における構造および微細構造の変化を評価するための信頼性の高いバイオマーカーを提供します。さらに、MRSは神経化学的変化に関するさらなる洞察を提供し、脳代謝物の変化を検出します。今後、さまざまな画像診断法を取り入れ、発症年齢や病期などのさまざまな要因によって参加者を層別化する多施設臨床試験を実施することで、FRDAに関するより包括的な理解が得られ、新たな治療法の開発に貢献することが期待されます。
フリードライヒ失調症と臨床試験における神経画像診断についてのご質問や、その他の画像診断サービスに関する具体的な情報提供など、当社のチームが喜んで対応いたします。
当社のイメージングサービスについてさらに詳しく知る
関連コンテンツ
神経疾患の臨床試験における神経画像診断の使用に関するベストプラクティスの最新情報。
脊髄小脳変性症の臨床試験とイメージングバイオマーカー
脊髄小脳変性症の臨床試験における疾患進行のモニタリングのための、構造MRI、DTI、MRSイメージングバイオマーカーの概要。
ハンチントン病臨床試験におけるPETイメージング
ハンチントン病(HD)の臨床試験におけるPETイメージングバイオマーカーの使用に関する概要。
結節性硬化症(TSC)の神経画像バイオマーカー
TSCの臨床試験における疾患修飾治療薬の効果をモニタリングするための、脳構造MRIおよび拡散強調画像バイオマーカーの概要。
ハンチントン病の臨床試験におけるMRIバイオマーカー
ハンチントン病(HD)の臨床試験における構造的および拡散MRI画像のバイオマーカーの使用に関する概要。
多系統萎縮症(MSA)の臨床試験におけるMRI
この資料では、MSAの研究におけるバイオマーカーとしての体積MRIと拡散強調画像(DWI)の有用性について概説しています。