この資料では、以下の内容について説明しています。
TSCの臨床試験でなぜ神経画像診断を用いるのでしょうか?
結節性硬化症(TSC)は、脳、皮膚、心臓、肺、腎臓に腫瘍が発生する多系統遺伝疾患であり、TSC1およびTSC2腫瘍抑制遺伝子の機能喪失型変異が原因で起こります。世界中で最大200万人がこの疾患に罹患しており、出生6,000~10,000件につき1件の割合で発症し、症例の最大3分の2は新生変異であるとされています(Henske, 2016 )。
TSCは、胎児の段階で症状が現れ始める生涯にわたる疾患であり、90~95%以上の症例で中枢神経系(CNS)が侵されます(Curatolo, 2015 ;Russo, 2020 )。 最も初期に症状が現れるのは中枢神経系であり、胎児の脳に上衣下結節(SEN)や皮質結節が現れます(Russo, 2020 )。上衣下結節は、時間の経過とともに上衣下巨細胞星細胞腫(SEGA)へと進化することがあり、脳室系で生命を脅かす閉塞性の腫瘍として成長する可能性があります。また、結節から皮質下の白質に広がる白質病変も見られます。
これらの解剖学的変化は、てんかん、自閉症スペクトラム障害(ASD)、知的障害、注意欠陥多動性障害(ADHD)、不安障害、うつ病などの、TSCに関連するさまざまな神経精神疾患(TAND)を引き起こします。てんかんは多くの場合、生後1年以内に発症し、3分の2の症例では医学的に難治性(すなわち、治療が困難または不可能)のままです(Henske, 2016 )。一方、自閉症スペクトラム障害は5歳までに発症します(Peters, 2013 )。生活の多くの認知面が影響を受け、行動レベル(攻撃性、不安、多動性、不注意)で早期に始まり、知的および学業レベルでの困難、そして生涯にわたる心理社会的(自尊心、親のストレス、人間関係の困難)および神経心理学的(二重課題、注意の切り替え、記憶)障害が続きます(Curatolo, 2015 )。
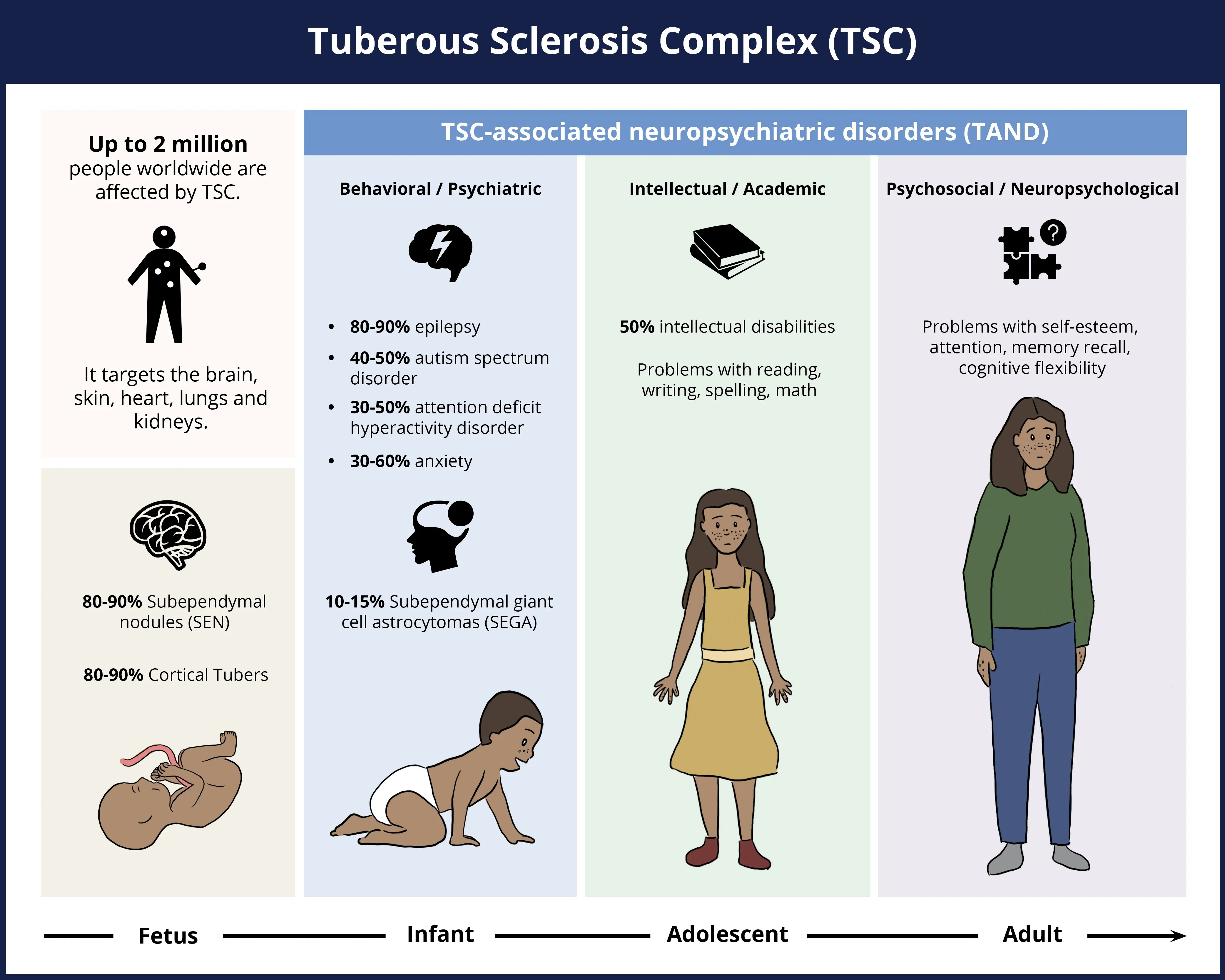
結節性硬化症(TSC)は、通常、胎児期に発症し、出生時から成人期まで、皮膚、心臓、肺、腎臓にも影響が及びますが、重度の神経疾患として症状が現れ続ける多系統疾患です。この疾患のさまざまな神経学的特徴または症状の発生率は、上の図に示されています。
多くの臓器がこの病気によって影響を受けますが、神経症状は最も頻繁に罹患の原因となるものであり、最も一般的な死因のひとつであると考えられています(Russo, 2020 )。このリソースでは、神経症状に焦点を当てています。したがって、神経画像診断は、診断だけでなく、病気のモニタリングや管理にも不可欠であると考えられています。特に、磁気共鳴画像法(MRI)は、神経学的障害を特定・確認し、TSC患者における経時的な変化を追跡するための基準となる方法として広く認識されています。
TSCの長期的な変化を評価するために使用できるMRIバイオマーカーはどれですか?
皮質結節の数と容積:いいえ
TSCは、死後の検査で厚く硬い溝として初めて記述された皮質結節にちなんで名付けられました(Henske, 2016 )。 これらは、大脳皮質の6層の組織が破壊された神経膠腫ではない塊であり、皮質溝から皮質下の白質にまで広がっていることもあります(Russo, 2020 )。これらは、TSCにおけるてんかんの主な原因であると考えられており、その数と空間分布は症状の重症度に関連しています。これらは大脳皮質のどこにでも見られますが、一般的に前頭葉と頭頂葉に存在し、また、小脳にも存在することがあります(Martí-Bonmatí, 2000 )。
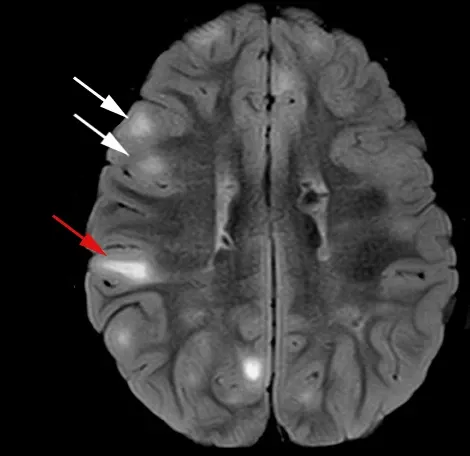
T2強調画像(FLAIR)で観察された皮質小体(白い矢印)と放射状移動線(赤い矢印)の例。図は、クリエイティブ・コモンズ表示ライセンスに基づき、Cohen et al.(Cohen, 2021 ) より複製および改変されています。
MRIでは、通常、T1強調画像(T1W)とT2強調画像(T2W)で検査され、場合によっては、より一般的な流体の減衰(FLAIR)も行われます。コントラストは脳の発達状態に依存しており、乳児ではT1Wで高信号、T2Wで低信号として最初に現れます(Russo, 2020 )。その後、ミエリンが成熟するとコントラストが反転し、結節は主にT2強調画像で高信号として現れ、加齢や神経変性疾患で観察される白質病変とよく似たものになります。いずれの場合も、病変のある脳回は肥厚し、灰白質と白質間の鮮明なコントラストが失われ、信号強度の勾配に置き換わります。
多くの異なる種類の塊茎が報告されています(Gallagher, 2010 ;El-Beheiry, 2018 ):
- タイプA:T2Wで高信号、T1Wで等信号
- タイプB:T2Wで高信号、T1Wで低信号
- タイプC:T2強調画像で高信号、T1強調画像で低信号、FLAIRで不均一、低信号のコア信号を囲む高信号の縁(「嚢胞状」)
- タイプD:タイプCに類似していますが、SWI(susceptibility-weighted imaging)ではブルーム効果が認められます。
後者のタイプの結節の数と容積が増大するにつれ、疾患の重症度および関連する神経障害も増大することが分かっています。例えば、大きな結節は一般的に、より多くのてんかん発作と関連しています。 胎児期を除いては、結節の大きさは長期間にわたって安定しているとされていますが(Russo, 2020 )、縦断的研究では、患者の半数が時間の経過とともに結節が変化したことが観察されています(Vaughn, 2013 ;Daghistani, 2015 )。ある症例研究では、嚢胞様病変(上記ではタイプCと表記)が実際に数とサイズを増大させる可能性があることが報告されています(Chu‐Shore, 2009 )。 造影剤の変化により嚢胞が新たに現れたように見える場合や、正常な脳の発達に比例して成長する場合もあります(Russo, 2020 )。 石灰化により、時間の経過とともに変化したように見える場合もあります(Vaughn, 2013 )。塊茎の数や容積が経時的に変化する(正常な発育に比例する範囲を超える)という広範な証拠は存在せず、また治療によって変化する可能性があるという証拠も存在しないため(新しい皮質組織が成長しない限り)、その数や容積は経時的な変化を追跡する優れたバイオマーカーとはなり得ませんが、依然として、この疾患の神経学的症状の重症度を代表する優れた画像バイオマーカーです。
SEN(亜上衣腫)の数:なし
SENは、脳室系の上衣に発生する直径1cm未満の良性の組織増殖です。 これらはしばしば石灰化し(Russo, 2020 )、その結果、CT(コンピュータ断層撮影)やT2*強調画像などの感受性強調MRIで容易に検出できます。また、T1強調画像(T1W)や場合によってはT2強調画像(T2W)でも高信号として現れます。SENは数が多い傾向があり、尾状核や視床の近くに位置することが多いですが、第3脳室や第4脳室の近くにあることもあります。
皮質結節と同様に、SENの数は一般的に、胎児期を越えて経時的に安定しており、石灰化に関連する変化のみを示します(Curatolo, 2015 )。そのため、経時的なバイオマーカーとしては有用ではないかもしれません。しかし、SENはSEGAへと成長する可能性があると考えられており、そのため、そのモニタリングは重要です。
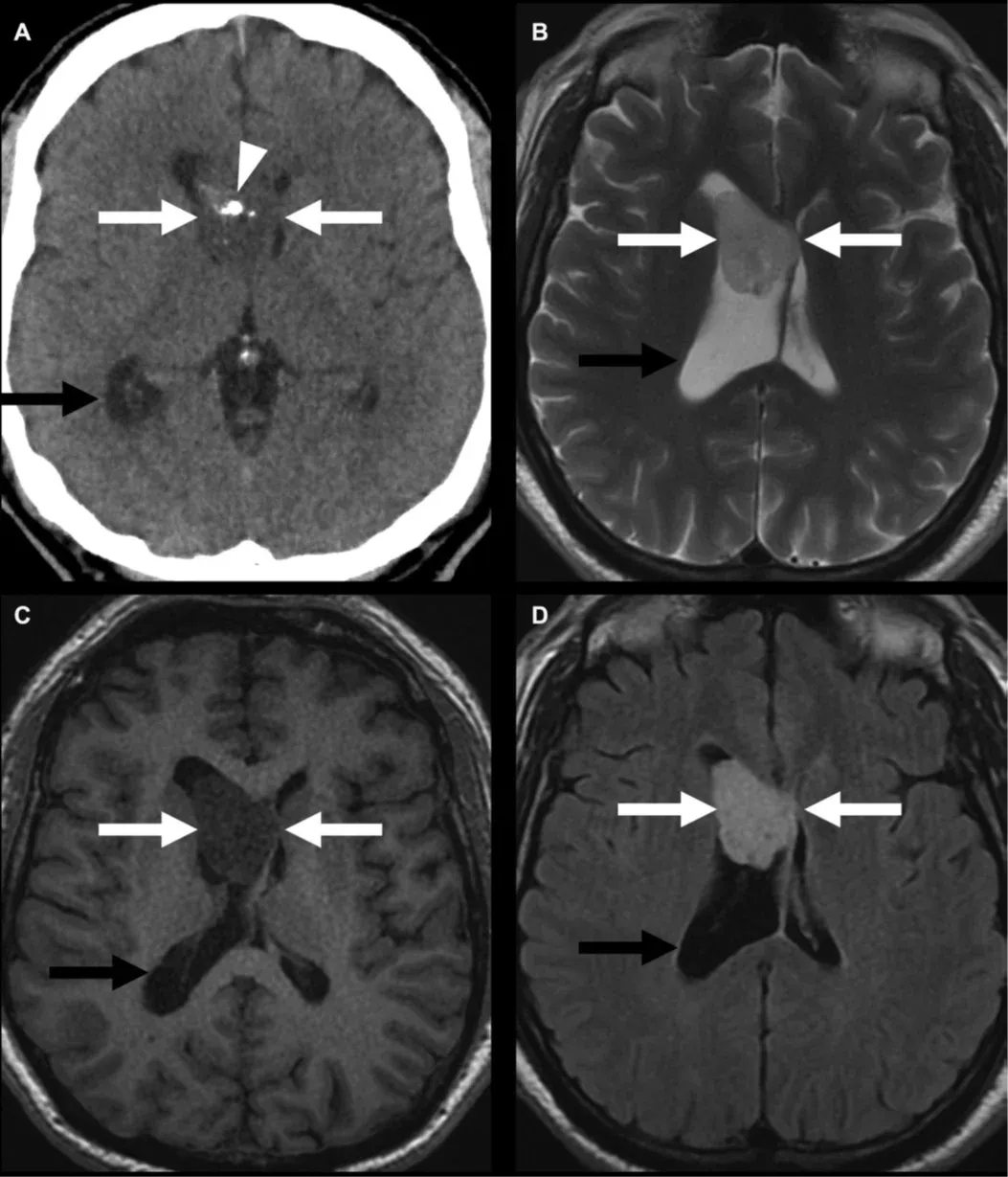
図は、TSH-IR症例の小脳に発生したWHOグレード1のsubependymoma(白矢印)の例で、TSC患者に認められるsubependymal giant cell astrocytomas(SEGA)に類似しています。コンピューター断層撮影(A)では石灰化(矢印)が認められ、T2W(B)、T1W(C)、および造影後(D)でも同様です。早期に発見できなければ、モンロー孔の閉塞による閉塞性水頭症(黒矢印)を引き起こす可能性があります。図は、クリエイティブ・コモンズ表示ライセンスに基づき、Mu et al.(Mu, 2023) より転載。
SEGA(亜ependymal巨細胞星細胞腫)の数と容積:はい
SEGAは、TSC患者の10~15%に発生するWHO悪性度1の良性グリオニューロンの腫瘍であり、一般的にSENから発生すると考えられています(Northrup, 2013 ;Roth, 2013 ;Henske, 2016 )。通常はゆっくりと成長しますが、心室系の閉塞(閉塞性水頭症)につながる可能性があるため、監視を行わないと生命を脅かす危険性があります。 これらの腫瘍は、ほぼ例外なくモンロー孔に隣接する尾状核溝で観察されるため、他の部位に存在するSENは通常は安全ですが、非典型的なSEGAの位置が報告されています(Russo、2020 )。標準治療では、2012年のコンセンサスガイドライン(Roth, 2013 )に従い、SEGAの発生を監視するために、通常は25歳までは1~3年ごとに、ルーチンの神経画像検査を行うよう規定されています。25歳という年齢が上限として選ばれたのは、それ以上の年齢では新たなSEGAがほとんど発症しないためですが、既存のSEGAは成長を続ける可能性があり、既存の病変の安定度に応じて追跡スキャン頻度を調整する必要があります。
MRIでの外観に関しては、SEGAは心室系内にほぼ完全に含まれる明瞭な腫瘤ですが、例外もみられます(Roth、2013年 )。T1WおよびT2Wコントラストは脳実質組織と類似していますが、外観は不均一です(Russo, 2020 )。 強烈なコントラスト増強を示しますが、造影剤の反復使用は推奨されていません。 SEGAは増大性であるため、その数と容積はTSCの長期的変化の関連バイオマーカーとなります。
白質異常:はい
白質病変は、放射状移行線(RML)からより微妙で広範囲にわたる白質異常まで、TSC患者のほぼ全員に認められます(Curatolo, 2015 ;Russo, 2020 )。 以前に述べた肉眼的な画像の特徴がTANDの症状のすべてを説明しているわけではないという認識が高まっており、白質異常がこの疾患の神経症状の一部に関連している可能性もあります。
RMLは、脳室周囲領域から皮質下の白質に広がる、MRI検査で確認できる線状の異常です。時に皮質結節とつながったり、白質で突然終わったりします。これは、神経細胞の移動障害の結果であると考えられています(Russo, 2020 )。皮質結節と同様に、乳児ではまずT1強調画像で軽度の高信号として現れ、その後、ミエリン化が進むとT2強調画像で高信号として現れます。より微妙な白質異常は、機能的MRI(fMRI)や拡散MRIなどの高度なMRI技術を用いて調査されており、正常に見える白質に広範な変化が起こっていることを示唆しています(Russo, 2020 )。これらの変化は5歳になるまで徐々に進行し、神経精神疾患の発症と時期を同じくして発生します。したがって、この潜在的に重要な介入期間における縦断的バイオマーカーとして有用である可能性があります(Peters, 2015 )。拡散MRIで最もよく測定できるこれらの白質変化については、次のセクションでさらに詳しく説明します。
拡散強調画像(DWI)は、TSC研究におけるバイオマーカーとして有用でしょうか?
拡散強調画像(DWI)または拡散MRIは、脳実質の微小構造の変化を調査するために頻繁に使用されます。一般的に、ミエリンは脂質であり、ミエリン鞘を横断する方向の拡散性を減少させるため、白質で使用され、ミエリン化と白質線維の完全性の相違や変化を捉えることができます。臨床現場では一般的に、見かけの拡散係数(ADC)マップが使用されていますが、臨床試験や研究の現場では、特に異方性(FA)や軸拡散性(最高拡散性の方向、通常は白質線維束の方向に対する相対値)などの適合メトリクスによって方向性の効果をうまく捉えることができるため、拡散テンソル画像(DTI)モデル(Le Bihan、2001年 )が一般的に使用されています。注目すべきは、FAが高い値を示す場合、一般的に白質が健康であることを意味し、これは白質がより緊密で、より多くの髄鞘化が起こり、組織化され、一貫性があることを反映しているのに対し、平均拡散性(MD)が高い値を示す場合、一般的に白質が損傷を受け、境界が一貫性を欠き、アストログリアが存在している可能性があることを反映していることです。神経線維配向分散密度イメージング(NODDI)モデル(Zhang, 2012 )など、より高度な拡散MRIモデルも存在しますが、通常、多施設臨床試験では困難な可能性がある、より高度な取得スキームを必要とします。
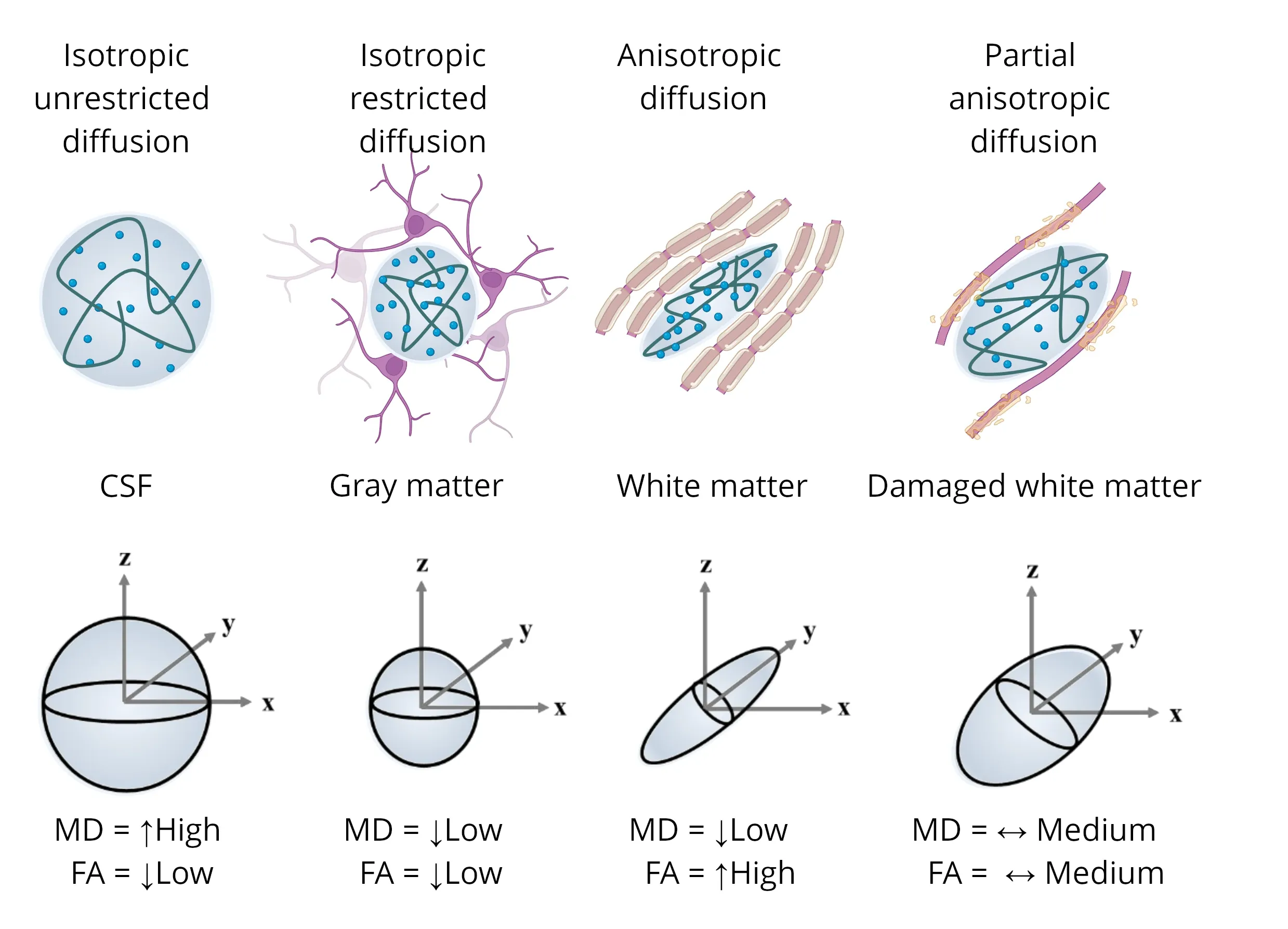
さまざまな微細構造から得られた拡散テンソルの図。異方性の水成分(楕円体の青い点で表示)が結果のテンソルに与える影響が強調されています。各シナリオには、平均拡散率(MD)と異方性率(FA)の表現が含まれています。図は、Colman et al.(Colman, 2022 ) の作品を、クリエイティブ・コモンズ表示ライセンスに基づき改変したものです。
DTIの研究では、従来のMRIでは確認できないほど、TSCでは皮質小結節の周辺に影響を受ける領域が大きいことが示されています(Peters, 2013 )。その小結節周辺領域は、TSC患者の正常に見える白質(NAWM)において、小結節内のFAが最も低くMDが最も高い値から、対照者の白質と同等な値まで、グラデーションを形成しているようです(Peters, 2015 )。腫瘍周囲領域におけるDTI指標の勾配は、ルクソール・ファスト・ブルー(LFB)染色法で評価したミエリンの組織病理学とよく相関することが示されています(Peters, 2019)。NAWMと比較した結節におけるFAの低値およびMDの高値は、その細胞組織および構造の無秩序化と一致しており、NAWMとの差異は結節のタイプ/重症度とともに増加し、タイプCの結節で最も顕著です(Gallagher, 2010 ;El-Beheiry, 2018 )。3つの領域(結節、結節周囲、NAWM)すべてにおいて、5歳まではFAの重要な増加とMDの減少が認められ、その後は変化の速度が遅くなり、健康な小児の白質における成熟変化と同様の変化が観察されます(Peters, 2015 )。結節および結節周囲領域のFAとMDは正常なレベルに達することはありませんが、これは結節周囲領域への介入の潜在的な余地があることを示している可能性があります。
結節や結節周囲領域のレベルまで影響が及んでいなくても、DTI指標の異常は、TSC患者のNAWMでも認められています。また、年齢をマッチさせた対照群と比較して、脳梁およびその投射部におけるFAが有意に低く、平均拡散度および放射状拡散度が有意に高いことも示されています。DTI測定値は結節容積とも相関しています(Makki, 2007 ;Simao, 2010 ;Peters, 2012 )。特に、自閉症スペクトラム障害(ASD)も併発しているTSC患者は、他のTSC患者と比較して有意に低いFAを示しました(Peters, 2012 )。 その後の研究でも同様の結果が示され、さらに、TSCとASD、知的障害、てんかんの併発は、それぞれ一見相加的な形で、脳梁のFA値の低下と関連していることが明らかになりました(Baumer, 2018 )。TACERN研究グループによる別の研究では、TSCとASDを併発している患者の複数の白質領域では、TSCのみを併発している患者と比較して、FAの経時的な増加が減少していることが分かりました(Prohl, 2019 )。しかし、同じグループによる後の縦断的研究では、有意な差は示されませんでした(Srivastava, 2024 )。これらの研究は、DTIが小児期に現れる神経学的負担および関連する神経精神疾患と相関していることから、臨床試験におけるバイオマーカーとして有用である可能性を示唆しています。
DTI測定値は、エベロリムスによる治療を受けたTSC患者の経時的な変化を有意に検出することもできました。エベロリムスは、SEGAおよび難治性てんかんの補助療法としてFDAが承認した治療薬です(Tillema, 2012 )。 12~18か月の治療後、脳梁およびその他の関心領域において、FAの増加とMDの減少が観察されましたが、対照群では同様の変化は認められませんでした。同様に、別の研究では、コントロール群では変化が見られなかったのに対し、治療群では脳梁のMDが減少することが観察されました(Peters, 2019)。さらに、特に若年者(10歳未満)のサブグループでは、より長期の治療によりMDの減少とFAの増加が観察され、これは別の臨床試験で観察された発作頻度の減少とよく似た結果でした(Franz, 2021 )。てんかん性結節では、他の結節よりもMDが高くFAが低いことが観察されています(Peters, 2013 )。また、同じ治療により、特に期間が長く、年齢が低いほど、DTI指標と発作頻度の両方の改善が観察されています。このデータは、DTI指標が特に早期介入に有用な経時的画像バイオマーカーとなり得ることを示す証拠であり、臨床試験において治療に反応する可能性があることを示しています。
当社のチームは、結節性硬化症の神経画像バイオマーカーに関するご質問にお答えしたり、当社の他の画像診断サービスに関する具体的な情報をご提供したりいたします。
当社のイメージングサービスについてさらに詳しく知る
関連コンテンツ
神経疾患の臨床試験における神経画像診断の使用に関するベストプラクティスの最新情報。
ハンチントン病臨床試験におけるPETイメージング
ハンチントン病(HD)の臨床試験におけるPETイメージングバイオマーカーの使用に関する概要。
MS臨床試験におけるガドリニウム造影MRI病変
多発性硬化症(MS)の臨床試験におけるガドリニウム(Gd)による病変の増強が、疾患の進行と治療介入への反応を追跡するためにどのように使用されているか。
フリードライヒ失調症の臨床試験におけるバイオマーカーのイメージング
フリードライヒ失調症(FRDA)の研究調査および多施設臨床試験におけるMRIおよびDTIイメージングバイオマーカーの使用に関する概要。