Pourquoi utiliser la neuro-imagerie dans les essais cliniques de la STB?
La sclérose tubéreuse de Bourneville (STB) est une maladie génétique multisystémique, caractérisée par la croissance de tumeurs dans le cerveau, la peau, le cœur, les poumons et les reins, et causée par des mutations de perte de fonction dans les gènes suppresseurs de tumeurs TSC1 et TSC2. Elle affecte jusqu'à 2 millions de personnes dans le monde, avec une incidence de 1 cas par 6 à 10 mille naissances, et jusqu'à deux tiers des cas démontrent des mutations de novo (Henske, 2016).
La STB est une maladie qui commence à se manifester in utero, et implique le système nerveux central (SNC) dans plus de 90-95% des cas (Curatolo, 2015; Russo, 2020). Les premières manifestations se présentent dans le cerveau à l’état foetal, avec l'apparition de nodules sous-épendymaires (SEN) et de tubers (Russo, 2020). Les nodules sous-épendymaires peuvent évoluer au fil du temps en tumeurs à cellules géantes sous-épendymaires (SEGA), pouvant grossir jusqu’à potentiellement bloquer le système ventriculaire du cerveau et être dangeureuses pour la vie. Des lésions de la matière blanche sont également présentes, s'étendant des tubers à la matière blanche sous-corticale.
Ces changements anatomiques entraînent à leur tour une grande variété de troubles neuropsychiatriques associés à la STB (TAND), dominés par l'épilepsie, le troubles du spectre autistique (TSA) et l’atteinte intellectuelle, ainsi que les troubles déficitaire de l'attention avec hyperactivité (TDAH), d’anxiété et de dépression. L'épilepsie commence souvent dans la première année de vie, et restera médicalement réfractaire (c'est-à-dire difficile à traiter ou intraitable) dans les deux tiers des cas (Henske, 2016), tandis que le TSA apparaît vers l'âge de 5 ans (Peters, 2013). De nombreux aspects cognitifs de la vie sont affectés, commençant tôt au niveau comportemental (agressivité, anxiété, hyperactivité, inattention), suivis de difficultés au niveau intellectuel et académique, et de troubles psychosociaux (estime de soi, stress parental, difficultés relationnelles) et neuropsychologiques (double tâche, changement d'attention, mémoire) tout au long de la vie (Curatolo, 2015).
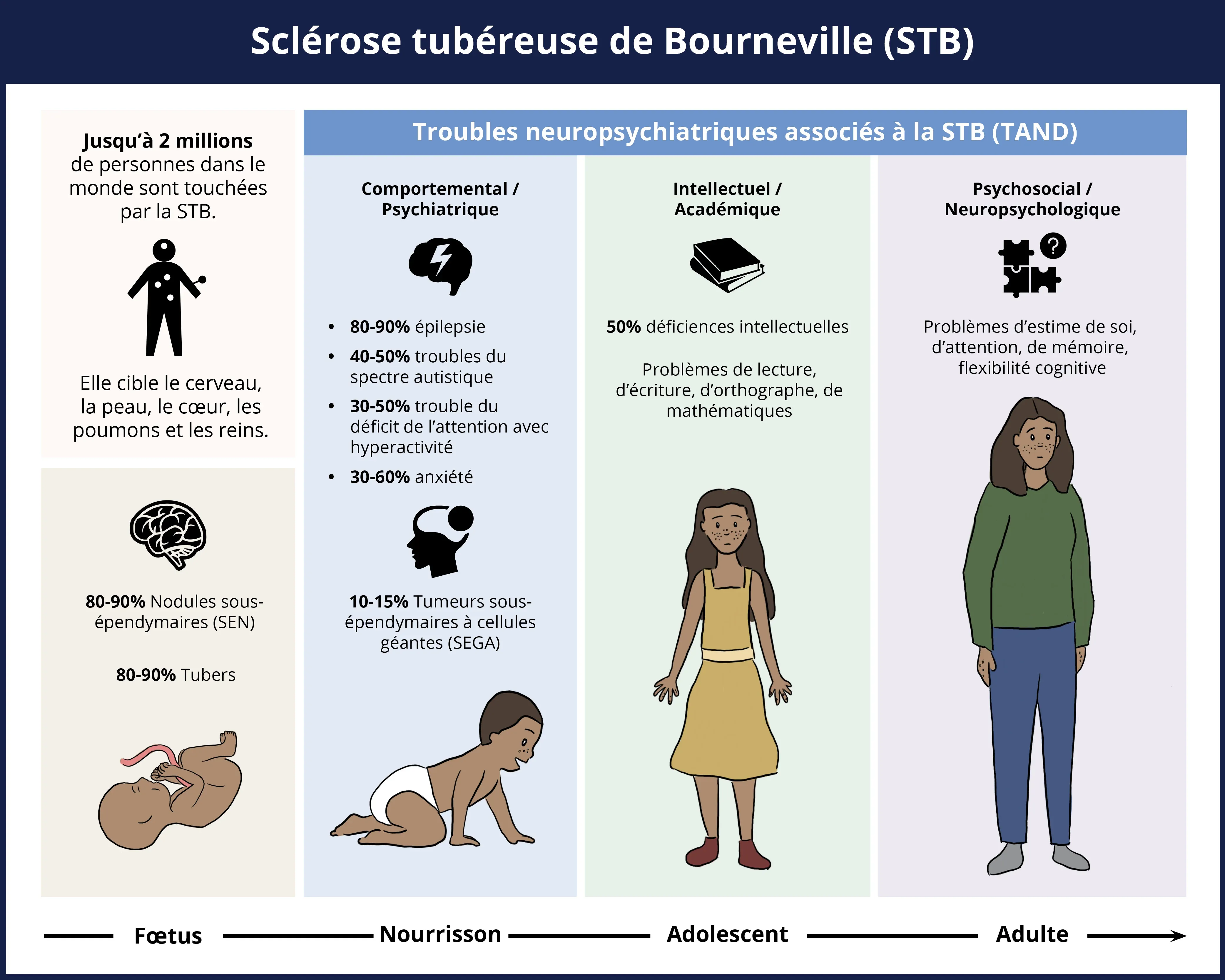
La sclérose tubéreuse de Bourneville (STB) est un trouble multisystémique qui se manifeste généralement dès l’état fœtal, et continue de se manifester de la naissance à l'âge adulte, marqué de façon substantielle par plusieurs troubles neurologiques, bien que la peau, le cœur, les poumons et les reins soient également affectés. Le pourcentage d'occurrence de diverses caractéristiques ou symptômes neurologiques de la maladie est indiqué sur la figure ci-dessus.
Tandis que de nombreux organes soient affectés par la maladie, les symptômes neurologiques sont considérés comme la cause la plus fréquente de morbidité et l'une des causes les plus courantes de mortalité (Russo, 2020), et font l'objet de la présente ressource. La neuro-imagerie est donc considérée comme essentielle non seulement pour le diagnostic, mais aussi pour le suivi et la gestion de la maladie. En particulier, l'imagerie par résonance magnétique (IRM) est largement reconnue comme la méthode de référence pour identifier et confirmer l'atteinte neurologique et suivre les changements au fil du temps chez les patients atteints de STB.
Quels biomarqueurs IRM peuvent être utilisés pour évaluer les changements longitudinaux dans la STB?
Nombre et volume des tubers: Non
La STB tire son nom des tubers, qui ont été décrits pour la première fois comme des gyri (circonvolutions) épais et fermes lors d'examens post-mortem (Henske, 2016). Ce sont des masses glioneurales non cancéreuses avec une organisation perturbée des 6 couches du cortex cérébral, s'étendant parfois des gyri à la substance blanche sous-corticale (Russo, 2020). Ils sont considérés comme la principale cause d'épilepsie dans la STB, et leur nombre et leur distribution spatiale sont liés à la gravité des symptômes. Bien qu'ils puissent être trouvés n'importe où dans le cortex cérébral, ils sont généralement présents dans les lobes frontaux et pariétaux, et peuvent également être infratentoriels (Martí-Bonmatí, 2000).
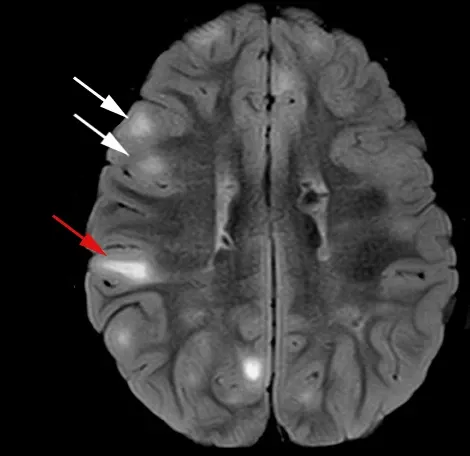
Exemples de tubers (flèches blanches) et de lignes de migration radiales (flèche rouge), comme observé sur des images pondérées en T2 avec atténuation de fluide (FLAIR). Figure reproduite et modifiée de Cohen et al. (Cohen, 2021), sous licence Creative Commons Attribution License.
En IRM, ils sont généralement étudiés avec des images pondérées en T1 (T1W) et en T2 (T2W), sans ou, plus couramment, avec atténuation de fluide (FLAIR). Le contraste dépend de l'état de développement du cerveau, et apparaît d'abord hyperintense en T1W et hypointense en T2W chez les nourrissons (Russo, 2020). Le contraste est ensuite inversé après la maturation de la myéline, et les tubers apparaissent principalement hyperintenses en T2W, semblables aux lésions de la substance blanche observées avec l'âge et dans les maladies neurodégénératives. Dans tous les cas, les gyri affectés apparaissent épaissis et il y a une perte de contraste net entre la matière grise et la matière blanche, remplacée par un gradient d'intensité de signal.
De nombreux types de tubers ont été décrits (Gallagher, 2010; El-Beheiry, 2018):
- Type A: hyperintense en T2W et isointense en T1W
- Type B: hyperintense en T2W et hypointense en T1W
- Type C: hyperintense en T2W, hypointense en T1W, hétérogène en FLAIR avec un signal central hypointense entouré d'un bord hyperintense («en forme de kyste»)
- Type D: similaire au type C avec «blooming» en imagerie pondérée en susceptibilité (SWI)
Il a été constaté qu'à mesure que le nombre et le volume des tubers des types ultérieurs augmentent, la gravité de la maladie et des troubles neurologiques associés augmente également. Par exemple, les tubers de type plus élevé sont généralement associés à plus de crises épileptiques. Bien qu'ils soient décrits comme stables en taille au fil du temps au-delà du développement fœtal (Russo, 2020), des études longitudinales ont observé que la moitié des patients avaient des tubers qui changeaient au fil du temps (Vaughn, 2013; Daghistani, 2015). Une étude de cas a rapporté que les lésions en forme de kyste spécifiquement (référées ci-dessus comme type C) peuvent en effet augmenter en nombre et en taille (Chu‐Shore, 2009). Il est possible que les tubers puissent sembler nouveaux en raison du changement de contraste ou croître proportionnellement au développement normal du cerveau (Russo, 2020). Ils peuvent également sembler changer au fil du temps en raison de la calcification (Vaughn, 2013). Comme il n'y a pas de consensus que les tubers changent en nombre ou en volume au fil du temps (au-delà de ce qui est proportionnel au développement normal), ou qu'ils peuvent changer en raison de traitements (à moins que de nouveaux tissus corticaux ne soient développés), leur nombre et leur volume ne sont pas considérés de bons biomarqueurs pour suivre les changements longitudinaux, mais restent de bons biomarqueurs d'imagerie représentatifs de la gravité des manifestations neurologiques de la maladie.
Nombre de SEN (nodules sous-épendymaires): Non
Les SEN sont des croissances tissulaires bénignes de moins de 1 cm de diamètre qui se développent dans la surface épendymaire du système ventriculaire du cerveau. Ils sont souvent calcifiés (Russo, 2020) et, par conséquent, peuvent être facilement détectés par tomodensitométrie (CT) et IRM pondérée en susceptibilité, comme l'imagerie pondérée en T2*. Ils apparaissent également hyperintenses en T1W et parfois en T2W. Ils tendent à être multiples en nombre, et situés généralement près du noyau caudé et du thalamus, mais peuvent également être présents près des troisième et quatrième ventricules.
Similaire aux tubers, le nombre de SEN est généralement stable au fil du temps au-delà du développement fœtal, n'exhibant que des changements liés à la calcification (Curatolo, 2015), et ne sont pas considérés utiles comme biomarqueurs longitudinaux. Cependant, on pense qu'ils peuvent croître en SEGA, et, par conséquent, leur surveillance est importante, comme décrit ci-après.
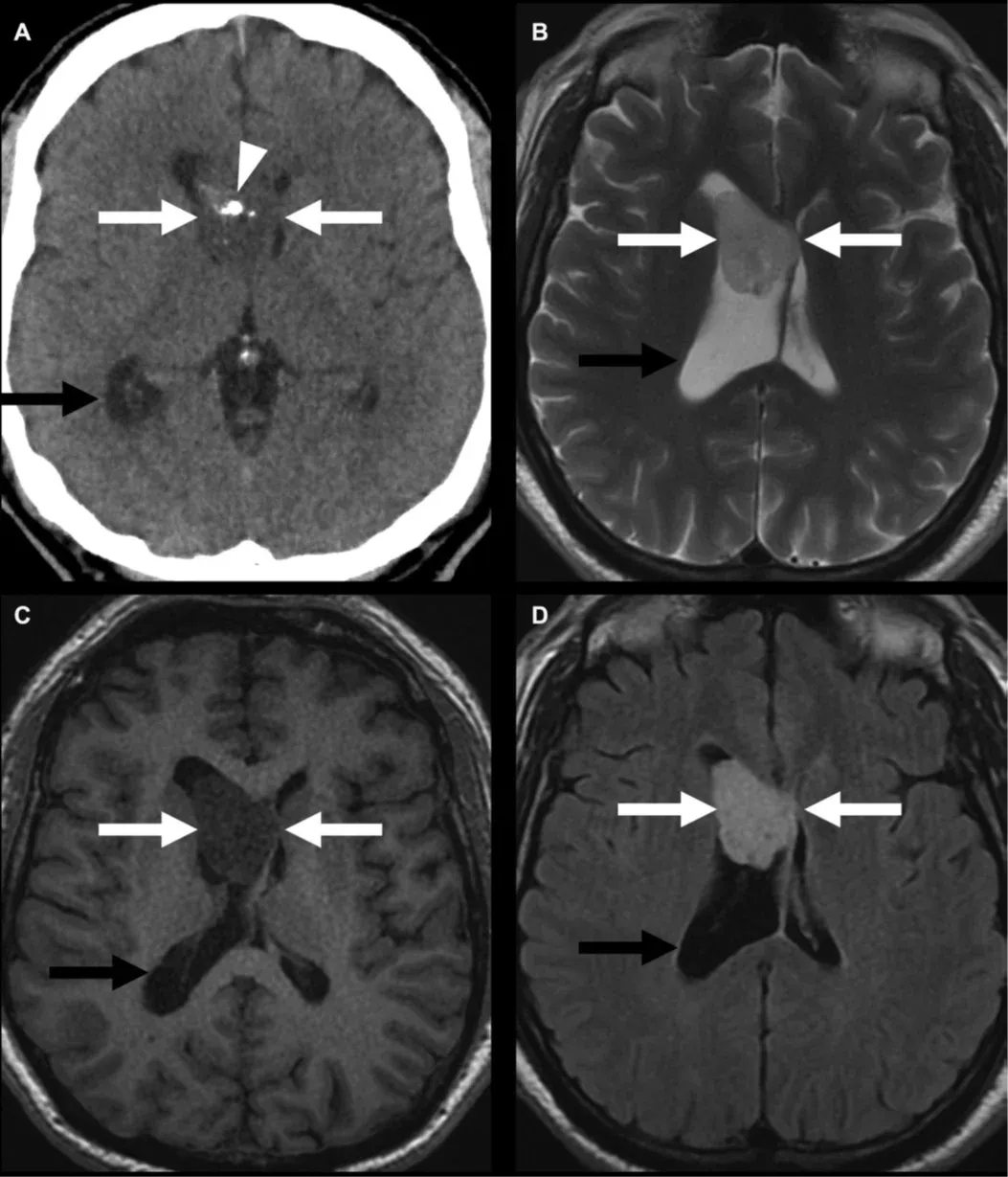
Exemple d'un sous-épendymome de grade 1 selon la classification de l'OMS (flèches blanches), similaire aux tumeurs à cellules géantes sous-épendymaires (SEGA) observés chez les individus atteints de STB, comme montré en tomodensitométrie (A) avec calcifications (tête de flèche), T2W (B), T1W (C) et avec rehaussement post-contraste (D). Si elles ne sont pas détectées tôt, elles peuvent entraîner une hydrocéphalie obstructive (flèche noire) en raison du blocage du foramen de Monro. Figure reproduite de Mu et al. (Mu, 2023) sous licence Creative Commons Attribution License.
Nombre et volume de SEGA (tumeurs à cellules géantes sous-épendymaires): Oui
Les SEGA sont des tumeurs glioneuronales bénignes de grade 1 (classification de l’OMS) survenant chez 10-15% des individus atteints de STB, et sont généralement considérées comme dérivant des SEN (Northrup, 2013; Roth, 2013; Henske, 2016). Bien qu'elles soient généralement à croissance lente, elles peuvent être mortelles si elles ne sont pas surveillées, car elles peuvent entraîner une obstruction du système ventriculaire (hydrocéphalie obstructive). Elles sont presque exclusivement observées au niveau du sillon caudothalamique adjacent au foramen de Monro, et, par conséquent, les SEN présents à d'autres endroits sont généralement sans danger, bien que des localisations atypiques de SEGA aient été rapportées (Russo, 2020). Les soins standard prescrivent des contrôles neuro-imagerie de routine pour surveiller le développement d'un SEGA, généralement tous les 1-3 ans jusqu'à l'âge de 25 ans, selon les lignes directrices consensuelles de 2012 (Roth, 2013). L'âge limite de 25 ans a été choisi car de nouveaux SEGA se développent rarement après cet âge, bien que les SEGA existants puissent continuer à croître, et la fréquence des scans de suivi doit être ajustée en fonction de la stabilité des lésions existantes.
En termes d'apparence en IRM, les SEGA sont des masses bien définies presque entièrement contenues à l'intérieur du système ventriculaire, bien que des exceptions puissent se produire (Roth, 2013). Leur contraste T1W et T2W est similaire au tissu parenchymateux cérébral, mais hétérogène en apparence (Russo, 2020). Ils montrent un contraste intense avec agent de contraste, bien que l'utilisation répétée d'agents de contraste ne soit pas recommandée. En raison de la nature croissante des SEGA, leur nombre et leur volume servent de biomarqueurs pertinents des changements longitudinaux de la STB.
Anomalies de la substance blanche: Oui
Les lésions de la substance blanche sont observées chez presque tous les individus atteints de STB, allant des lignes de migration radiales (RML) à des anomalies plus subtiles et diffuses de la substance blanche (Curatolo, 2015; Russo, 2020). Il y a une reconnaissance croissante que les caractéristiques d'imagerie macroscopiques mentionnées précédemment ne peuvent être attribuées à toutes les manifestations TAND, et les anomalies de la substance blanche peuvent être liées à certaines des symptômes neurologiques de la maladie.
Les RML sont des lignes visibles à l'examen IRM irradiant de la zone périventriculaire vers la substance blanche sous-corticale, se connectant parfois aux tubers ou se terminant abruptement dans la substance blanche, considérées comme la conséquence d'une migration neuronale altérée (Russo, 2020). Similaires aux tubers, elles apparaissent d'abord légèrement hyperintenses en T1W chez les nourrissons avant de devenir hyperintenses en T2W après la myélinisation. Des anomalies plus subtiles de la substance blanche ont été étudiées avec des techniques avancées d'IRM telles que l'IRM fonctionnelle (IRMf) et l'IRM de diffusion, suggérant des changements étendus dans la substance blanche d'apparence normale (Russo, 2020). Ces changements se développent progressivement jusqu'à l'âge de 5 ans, coïncidant avec l'apparition des troubles neuropsychiatriques, et peuvent donc être des biomarqueurs longitudinaux utiles pendant cette fenêtre d'intervention potentiellement critique (Peters, 2015). Ces changements de la substance blanche, mieux mesurés avec l'IRM de diffusion, sont décrits plus en détail dans la section suivante.
L'imagerie pondérée en diffusion est-elle utile comme biomarqueur dans les études sur la STB?
L'imagerie pondérée en diffusion, ou IRM de diffusion, est souvent utilisée pour étudier les altérations de la microstructure du parenchyme cérébral. Elle est généralement utilisée dans la substance blanche car la myéline est un lipide qui réduit la diffusivité de manière directionnelle à travers la gaine de myéline, et, par conséquent, les différences et les changements de myélinisation et de l'intégrité des fibres de la substance blanche peuvent être capturés. Bien que les images du coefficient de diffusion apparent (ADC) soient couramment utilisées en clinique, le modèle d'imagerie par tenseur de diffusion (DTI) (Le Bihan, 2001) est généralement utilisé dans les essais cliniques et la recherche, car il peut bien capturer ces effets directionnels avec ses métriques ajustées, en particulier l'anisotropie fractionnelle (FA), mais aussi la diffusivité axiale et radiale (par rapport à la direction de la plus grande diffusivité, généralement la direction d'un faisceau de fibres de la substance blanche). À noter que des valeurs plus élevées de FA représentent généralement une substance blanche plus saine, car elles représentent une substance blanche plus serrée, plus myélinisée, organisée et cohérente, tandis que des valeurs plus élevées de diffusivité moyenne (MD) reflètent généralement une substance blanche plus perméable, endommagée, avec des limites moins cohérentes et où une astrogliose peut être présente. Des modèles d'IRM de diffusion plus avancés existent, tels que le modèle d'imagerie de la dispersion et de la densité des neurites (NODDI) (Zhang, 2012), mais ils nécessitent généralement des séquences d'acquisition IRM plus avancées qui peuvent être difficiles à réaliser dans un essai clinique avec plusieurs centres.
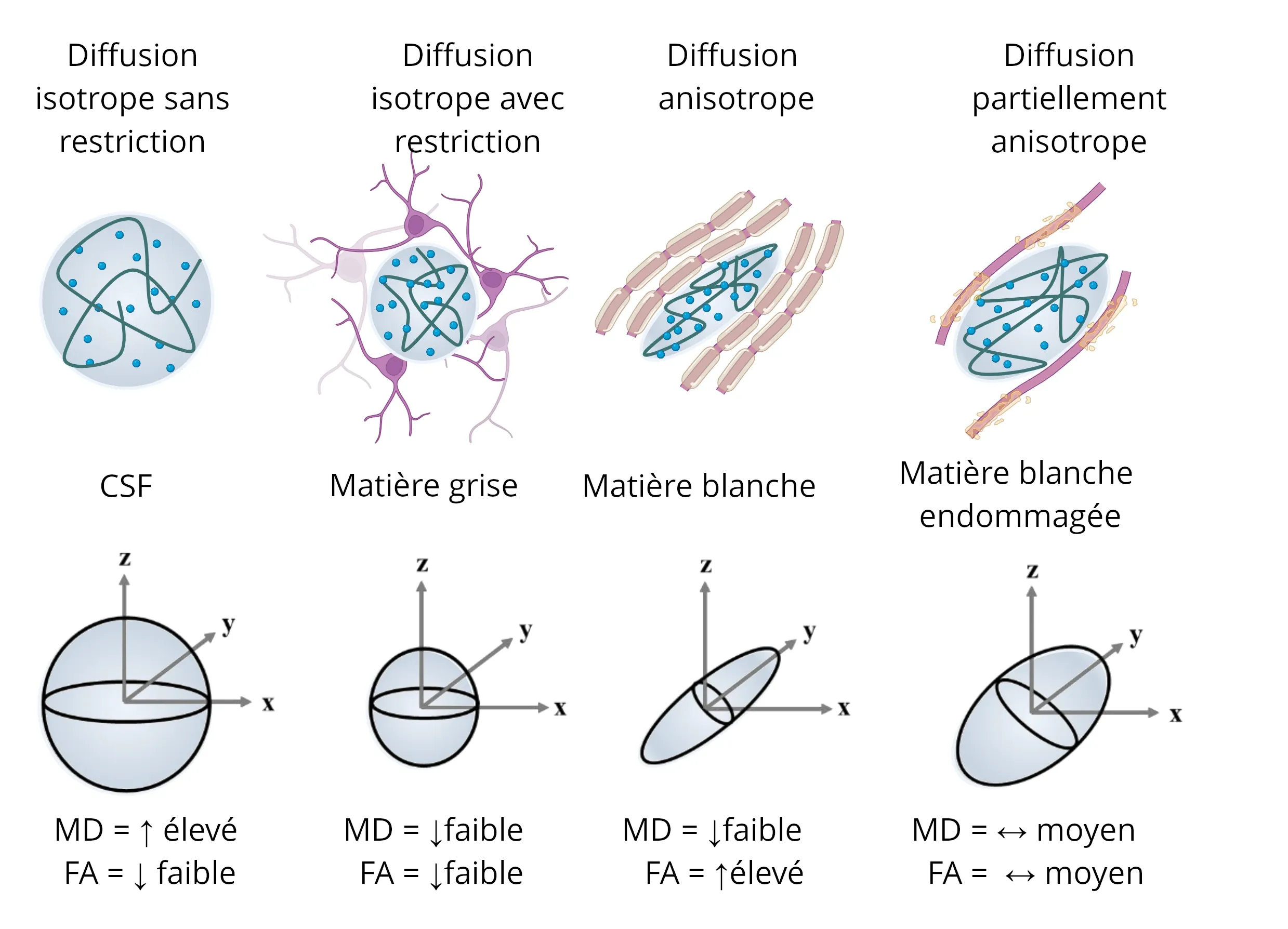
Illustrations de tenseurs de diffusion provenant de diverses microstructures, mettant en évidence l'influence de la composante anisotrope de l'eau (représentée par les ellipsoïdes bleues) sur les tenseurs résultants. Chaque scénario inclut des représentations de la diffusivité moyenne (MD) et de l'anisotropie fractionnelle (FA). Figure adaptée de Colman et al. (Colman, 2022) sous licence Creative Commons Attribution License.
Les études DTI ont montré qu'il existe une zone plus large autour des tubers qui est affectée dans la STB, que ce qui peut être vu avec l'IRM conventionnelle (Peters, 2013). Cette zone péritubérale semble former un gradient allant de la FA la plus basse et de la MD la plus élevée à l'intérieur du tuber, jusqu’à des valeurs comparables à la substance blanche chez les témoins dans la substance blanche d'apparence normale (NAWM) des individus atteints de STB (Peters, 2015). Ce gradient dans les métriques DTI dans la zone péritubérale a été montré à bien corréler avec l'histopathologie de la myéline, évaluée avec le bleu de luxol rapide (Peters, 2019). La faible FA et la haute MD dans les tubers par rapport à la NAWM sont cohérentes avec leur organisation cellulaire désorganisée connue et leur structure, et les différences par rapport à la NAWM augmentent également avec le type/la gravité des tubers, les plus marquées étant dans les tubers de type C (Gallagher, 2010; El-Beheiry, 2018). Les trois zones (tuber, péritubérale, NAWM) montrent une augmentation importante de la FA et une diminution de la MD jusqu'à l'âge de 5 ans, après quoi un taux de changement plus lent est observé, similaire aux changements de maturation dans la substance blanche des enfants en bonne santé (Peters, 2015). La FA et la MD du tuber et de la zone péritubérale n'atteignent jamais des niveaux normaux, ce qui peut représenter une fenêtre potentielle d'intervention dans les zones péritubérales.
Même si elles ne sont pas affectées au niveau des tubers ou de la zone péritubérale, des anomalies dans les métriques DTI ont également été trouvées dans la NAWM des individus atteints de la STB. Il a également été montré qu'ils avaient une FA significativement plus basse et une diffusivité moyenne et radiale plus élevée dans le corps calleux et ses projections que les témoins appariés en âge, avec des mesures DTI corrélant également avec le volume des tubers (Makki, 2007; Simao, 2010; Peters, 2012). En particulier, les individus atteints de la STB qui avaient également un trouble du spectre autistique (TSA) montraient une FA significativement plus basse que les autres individus atteints de STB (Peters, 2012). Une étude ultérieure a montré des résultats similaires, ajoutant en outre que la co-occurrence de STB avec TSA, une atteinte intellectuelle et l'épilepsie étaient chacun associés à des valeurs de FA callosale plus basses de manière apparemment additive (Baumer, 2018). Une autre étude du groupe d'étude TACERN a trouvé une augmentation longitudinale réduite de la FA au fil du temps dans plusieurs régions de la substance blanche des individus atteints de STB et de TSA par rapport aux individus atteints de STB sans TSA (Prohl, 2019), bien qu'une étude longitudinale ultérieure du même groupe n'ait pas montré de différences significatives (Srivastava, 2024). Ces études suggèrent que le DTI peut être utile comme biomarqueur dans les essais cliniques car il corrèle avec la charge neurologique et les troubles neuropsychiatriques associés apparaissant pendant l'enfance.
Les métriques DTI ont également pu détecter de manière significative les changements longitudinaux chez les patients atteints de STB traités avec l'évérolimus, un traitement approuvé par la FDA pour les SEGA et pour le traitement adjuvant des crises réfractaires (Tillema, 2012). Une augmentation de la FA et une diminution de la MD ont été observées après 12-18 mois de traitement dans le corps calleux et d'autres régions d'intérêt, sans changement correspondant dans le groupe témoin. De même, la MD a été observée à diminuer dans le corps calleux du groupe traité, tandis qu'elle est restée inchangée pour le groupe témoin dans une étude distincte (Peters, 2019). De plus, une plus grande diminution de la MD et augmentation de la FA ont été observées avec un traitement plus long, en particulier dans le sous-groupe plus jeune (moins de 10 ans), semblable à ce qui a été observé pour la réduction de la fréquence des crises dans un essai clinique distinct (Franz, 2021). Comme une MD plus élevée et une FA plus basse sont observées dans les tubers épileptogènes que dans d'autres tubers (Peters, 2013), et que des améliorations dans les deux métriques DTI et la fréquence des crises ont été observées avec le même traitement, en particulier avec une durée plus longue et à un âge plus jeune, ces données fournissent des preuves que les métriques DTI peuvent être un biomarqueur d'imagerie longitudinal utile, en particulier pour une intervention précoce, et qu'elles peuvent répondre au traitement dans un essai clinique.
Notre équipe se fera un plaisir de répondre à vos questions sur les biomarqueurs de neuro-imagerie pour la sclérose tubéreuse de Bourneville ou de vous fournir des informations spécifiques sur nos autres services d'imagerie.
Découvrez nos services d'imagerie
Contenu connexe
Informations actualisées sur les meilleures pratiques liées à l'utilisation de la neuroimagerie dans les essais cliniques sur les maladies neurologiques.
Biomarqueurs TEP dans les essais cliniques sur la maladie de Huntington
Un aperçu de l'utilisation des biomarqueurs d'imagerie TEP pour les essais cliniques de la maladie de Huntington (MH).
Essais cliniques sur les lésions renforcées par le gadolinium en IRM dans la SP
Comment les lésions rehaussées par le gadolinium (Gd) sont utilisées pour suivre la progression de la maladie et la réponse à l'intervention thérapeutique dans les essais cliniques sur la sclérose en plaques (SP).
Biomarqueurs d'imagerie pour les essais cliniques sur l'ataxie de Friedreich
Un aperçu de l'utilisation des biomarqueurs d'imagerie IRM et DTI pour l'ataxie de Friedreich (FRDA) dans les études de recherche et les essais cliniques multicentriques.
Démence frontotemporale (DFT) et atrophie cérébrale par IRM
Biomarqueurs IRM (y compris l'atrophie cérébrale) issus des études FTLDNI sur l'histoire naturelle de la démence frontotemporale (DFT).