Cette ressource décrit:
- Quels sont les différents types de lésions qui peuvent être évalués à l'aide d'un scanner rehaussé au Gd ou pondéré en T2 dans la SP?
- Comment une lésion rehaussée par le gadolinium évolue-t-elle dans le temps?
- Comment les rehaussements au gadolinium sont-ils utilisés pour surveiller l'efficacité des traitements dans les essais cliniques sur la SP?
- Quelles autres techniques d'imagerie peuvent être utilisées pour surveiller la progression de la SP?
Quels sont les différents types de lésions qui peuvent être évalués à l'aide d'un scanner rehaussé au Gd ou pondéré en T2 dans la SP?
Les premières études sur le rehaussement par le gadolinium ont montré qu'il augmentait considérablement la sensibilité de l'IRM cérébrale mensuelle dans le suivi du traitement de la sclérose en plaques récurrente-rémittente ou secondairement progressive (Miller, 1993; Koudriavtseva, 1997). Elle améliore le contraste des images en rehaussant les zones où (1) la perméabilité de la barrière hémato-encéphalique (BHE) est accrue, (2) la perméabilité des capillaires ou des vaisseaux sanguins locaux est plus élevée en raison d'une inflammation à médiation immunitaire, et (3) il existe des zones tissulaires à forte teneur en protéines ou une matrice tissulaire altérée en raison d'une fibrose ou d'une inflammation chronique indiquant une inflammation récente ou en cours (Minagar, 2003).
L'imagerie par résonance magnétique (IRM) a été officiellement incluse dans le bilan diagnostique des patients présentant un syndrome cliniquement isolé (SCI) évocateur de sclérose en plaques (SP) en 2001 (McDonald, 2001). Bien que le diagnostic puisse être posé en l'absence de rehaussement au gadolinium, celui-ci reste la seule caractéristique reconnue pour évaluer la chronicité des lésions IRM au moment de la première évaluation (Thompson, 2018).
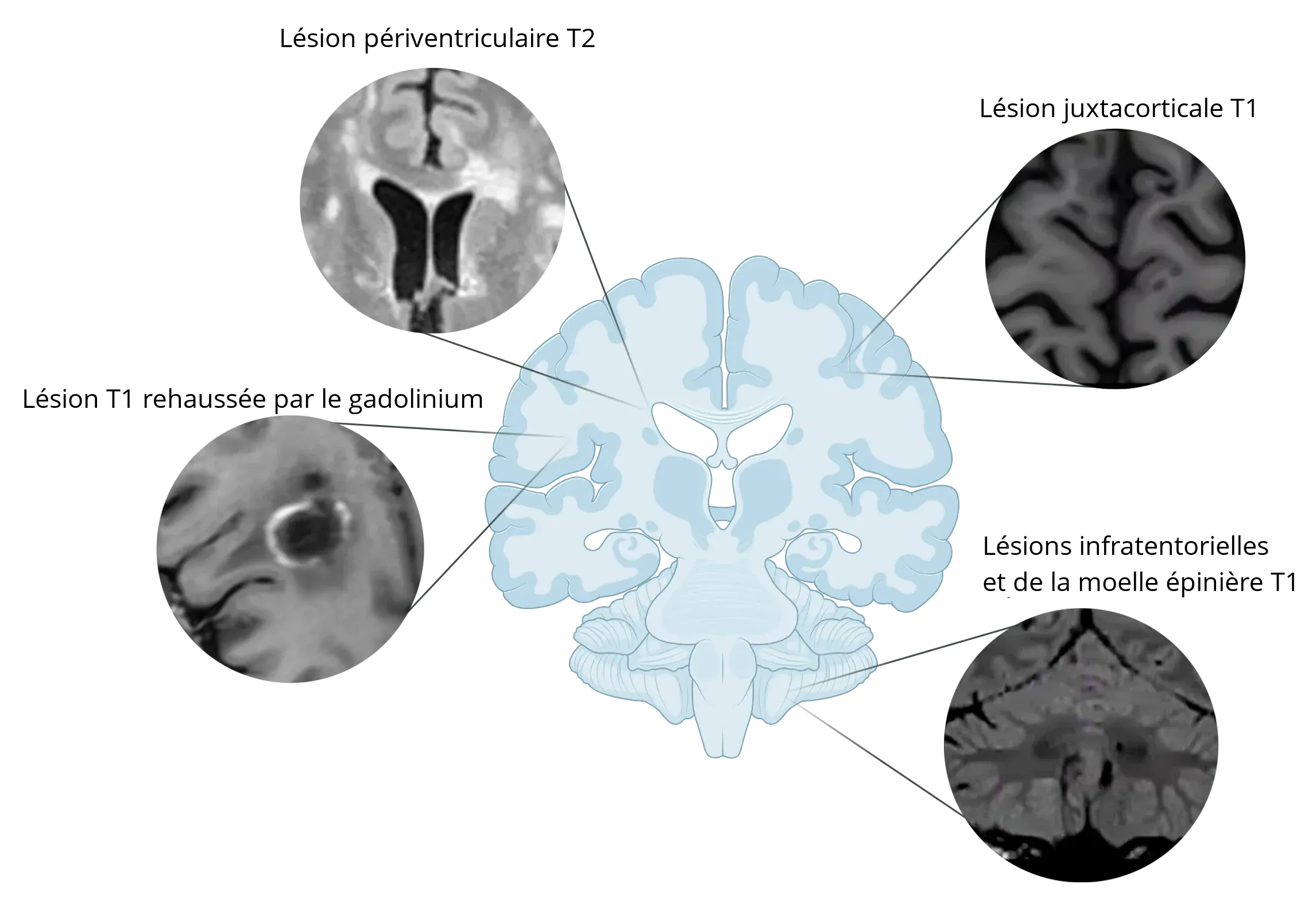
Exemples de lésions de SP à différents endroits du cerveau.
Comment évolue une lésion rehaussée par le gadolinium au fil du temps?
Phase initiale (lésion aiguë)
La lésion se rehausse initialement avec du gadolinium en raison d'une inflammation aiguë. Cette observation est typiquement associée à une démyélinisation active et est visible à l'IRM sous la forme d'une lésion hyperintense sur les images pondérées en T1. Cette phase est souvent corrélée à une rechute clinique ou à de nouveaux symptômes neurologiques, car le processus inflammatoire peut entraîner divers symptômes en fonction de la localisation de la lésion (Thompson, 2018).
Phase subaiguë
En l'espace de quelques semaines (généralement de 2 à 6 semaines), l'amélioration peut diminuer ou disparaître à mesure que l'inflammation diminue et que la BHE commence à se réparer. Pendant cette phase, la lésion peut encore être visible comme hyperintense sur les images IRM pondérées en T2 en raison de l'œdème et de la démyélinisation en cours, mais elle ne présentera pas de rehaussement sur les images pondérées en T1 (Filippi, 2016).
Phase chronique
Lorsque le processus inflammatoire se résorbe, la lésion ne se rehausse généralement plus à l'IRM de contrôle. À ce stade, elle peut être classée comme une lésion chronique ou inactive. La lésion peut rester hyperintense sur les images pondérées en T2, mais elle peut apparaître hypointense (trou noir) sur les images pondérées en T1, ce qui indique des lésions axonales et une gliose (cicatrice gliale) importantes. La présence de trous noirs en T1 suggère des lésions tissulaires irréversibles (Rocca, 2017). Avec le temps, les lésions chroniques peuvent se stabiliser et leur apparence peut ne pas changer de manière significative. Cependant, certaines lésions chroniques peuvent se réactiver, entraînant une nouvelle inflammation et un rehaussement au gadolinium en cas de résurgence de l'activité de la maladie (Polman, 2011).
Comment les rehaussements au gadolinium sont-ils utilisés pour surveiller l'efficacité des traitements dans les essais cliniques sur la SP?
Les critères d'évaluation primaires traditionnels des essais cliniques de phase 3 sur la SP sont l'échelle EDSS (Expanded Disability Status Scale) et le taux de rechute. Les critères d'évaluation secondaires dans ces essais comprennent le nombre ou le volume des lésions hyperintenses T2 et des lésions T1 rehaussées par le gadolinium sur les images IRM du cerveau. Ces dernières sont toutefois souvent utilisées comme critères d'évaluation primaires dans les essais de phase 2. Ces mesures ont été généralement acceptées comme mesures des effets (à court terme) du traitement (van Munster, 2017).
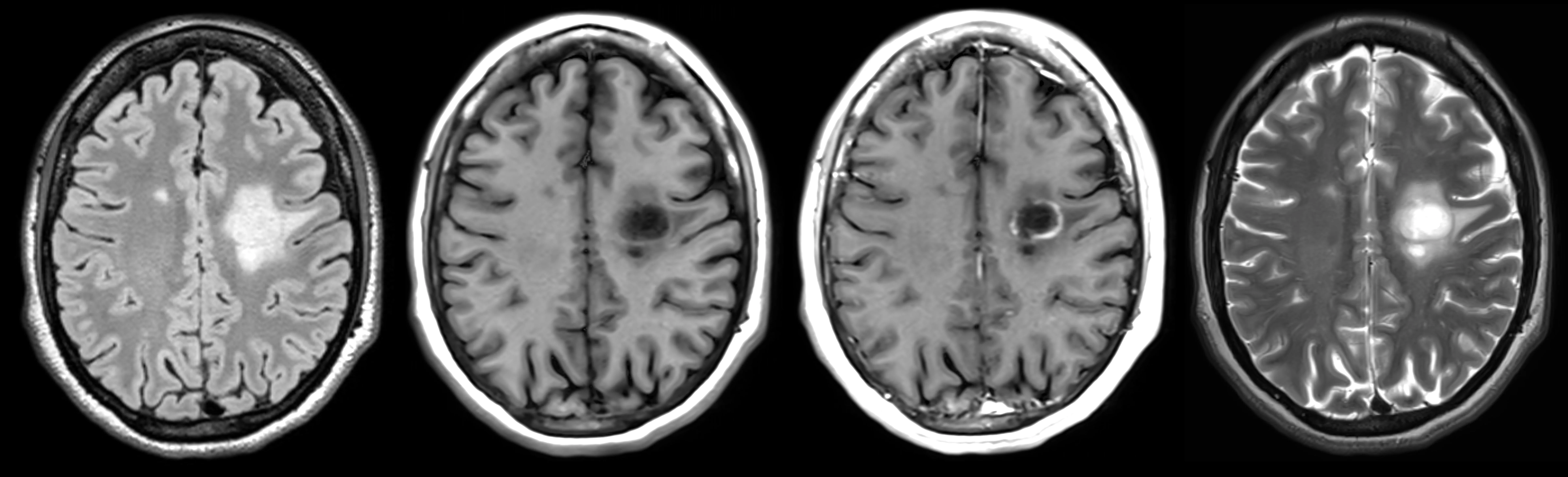
Exemple de modalités d'IRM utilisées comme paramètres d'imagerie dans les essais cliniques. De gauche à droite : images FLAIR, pondérées en T1 (sans contraste), pondérées en T1 avec gadolinium et pondérées en T2. Données aimablement fournies par Lesjak et al. (Lesjak, 2018) et traitées par Biospective.
L'expression clinique et l'évolution de la maladie sont très variables, ce qui empêche de définir un concept uniforme de handicap dans la sclérose en plaques. Les principaux facteurs d'hétérogénéité sont les suivants : (1) la fréquence des poussées varie considérablement d'un patient à l'autre, (2) la mesure dans laquelle les symptômes contribuent à l'incapacité globale peut dépendre davantage de la localisation de la lésion que de sa taille ou de son activité, (3) les lésions peuvent se manifester de manière subclinique sans entraîner d'aggravation de l'incapacité, et (4) comme l'incapacité s'accumule souvent lentement, un suivi à long terme est nécessaire pour évaluer les effets du traitement (Weinshenker, 1989; Barkhof, 2002).
Néanmoins, la pathologie de la substance blanche a une valeur prédictive pour l'évolution clinique de la maladie et peut expliquer une partie de l'effet du traitement. Les patients présentant des signes IRM de mauvaise réponse au traitement par IFN-β, définis par ≥2 nouvelles lésions T2 hyperintenses ou de nouvelles lésions rehaussées par le gadolinium, présentaient un risque significativement accru de rechutes et de progression futures (Dobson, 2013). Les effets du traitement sur les nouvelles lésions sur une période d'un an ont permis d'obtenir une bonne proportion (70 %) des effets sur les rechutes au cours de l'année suivante (Sormani, 2011).
Cependant, en raison des préoccupations sanitaires liées à l'utilisation d'agents de contraste à base de gadolinium, une étude récente du groupe de travail ESMRMB-GREC et ESNR sur la sclérose en plaques (Rovira, 2024) a conclu que les lésions T2 avec prise de contraste, nouvelles ou élargies, fournissent des informations redondantes, du moins dans le cadre d'un suivi régulier de la maladie. Par conséquent, leur utilisation dans le suivi de routine n'est pas obligatoire et doit être réduite. Heureusement, l'utilisation de techniques d'imagerie sans contraste donne des résultats prometteurs dans le suivi de la progression de la maladie et de l'efficacité du traitement (Granziera, 2021).
Quelles autres techniques d'imagerie peuvent être utilisées pour surveiller la progression de la SP?
Il a été démontré que plusieurs mesures IRM présentent une meilleure corrélation avec les processus neurodégénératifs de la SP que les mesures convectives (van Munster, 2017). En particulier, l'atrophie du cerveau entier et de la matière grise présente une forte corrélation avec l'invalidité et les troubles cognitifs, à la fois transversalement et longitudinalement. Une méta-analyse a montré que l'atrophie du cerveau entier chez les patients ayant reçu un traitement immunomodulateur était plus faible que dans le groupe placebo (Tsivgoulis, 2015).
Un autre biomarqueur IRM de la neurodégénérescence est la formation de trous noirs persistants (PBH), définis comme des lésions hyperintenses T2 non rehaussées (T2HL) avec une intensité de signal persistante entre celle de la matière grise et celle du LCR sur les scanners pondérés en T1. On estime qu'environ 30 à 40 % des lésions T2HL actives évolueront finalement en PBH dans les 6 à 12 mois (Van Walderveen, 1998). Certains essais cliniques ont mis en évidence des effets significatifs du traitement sur la réduction de la formation de PBH (Barkhof, 2001; Filippi, 2001; Dalton, 2004).
Les mesures de relaxométrie T1 (par exemple T1-RT) sont sensibles à la myéline, aux axones et à l'eau libre. Lorsqu'elles sont appliquées à la quantification des trous noirs, il a été démontré qu'elles présentent une meilleure corrélation avec les scores fonctionnels cliniques composites qu'avec le volume total de la lésion du trou noir (Thaler, 2017), et la diminution au fil du temps du T1-RT à l'intérieur des trous noirs est associée à l'amélioration clinique et à la réponse à la thérapie (Thaler, 2017).
Les mesures de relaxométrie T2, telles que la relaxométrie T2 à composante unique (qT2), le rapport de transfert de magnétisation (MTR) et la fraction d'eau de la myéline (MWF) offrent un aperçu de la teneur en fer liée à la myéline, comme validé par des études post-mortem (Langkammer, 2010; Laule, 2018). La fraction aqueuse de la myéline a été signalée comme montrant une démyélinisation plus prononcée dans les lésions avec des bords paramagnétiques par rapport aux lésions sans bords (Yao, 2018). Les modifications de la MTR dans la substance blanche d'apparence normale (NAWM) ont précédé l'apparition des lésions rehaussées par le gadolinium chez les patients atteints de sclérose en plaques, en particulier chez les patients traités (Filippi, 1998; Oh, 2019).
Les mesures d'imagerie pondérée par la diffusion (DWI), qui modélisent les changements de signal associés à la diffusion des molécules d'eau dans les tissus, sont largement disponibles dans la recherche clinique et la pratique clinique, et sont utilisées depuis de nombreuses années pour évaluer l'intégrité des tissus du CNS à la fois dans les régions d'intérêt et le long des voies spécifiques de la substance blanche (Song, 2002; Bodini, 2014). Les études d'IRM sur la sclérose en plaques montrent que des augmentations de la diffusivité moyenne (MD) ont été signalées jusqu'à 6 semaines avant le rehaussement du contraste (Rocca, 2000; Werring, 2000). Il a également été démontré que la MD dans les lésions qui se rehaussent est beaucoup plus faible que dans les lésions qui ne se rehaussent pas, et qu'elle prédit le risque de développer des trous noirs persistants (Naismith, 2010; Werring, 2000).
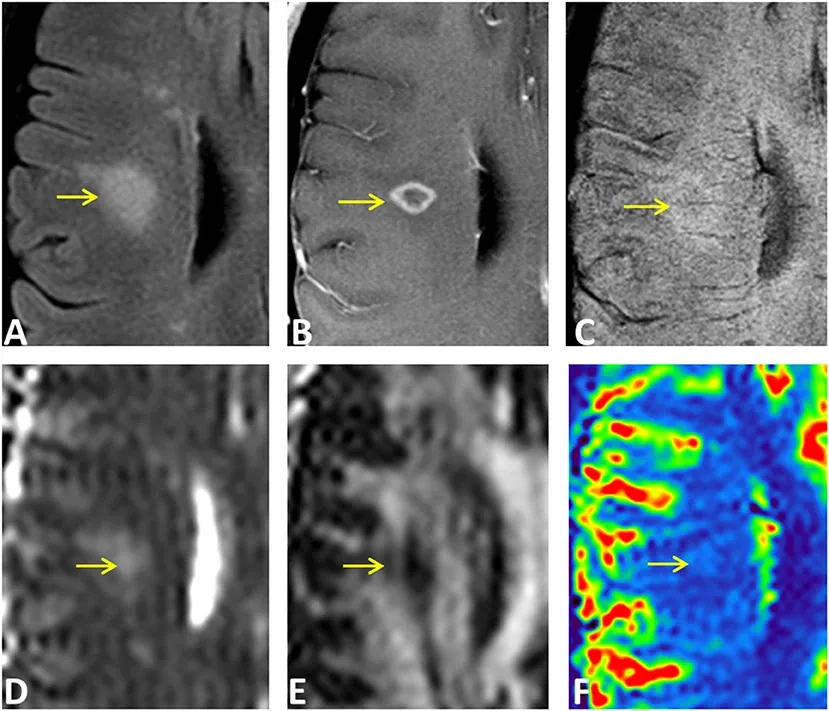
Exemple de modalités IRM multiples appliquées à une lésion à rehaussement annulaire chez un patient atteint de sclérose en plaques. La région de la lésion est indiquée par une flèche jaune en (A) FLAIR, (B) IRM pondérée T1 avec Gd, et (C) SWI, ainsi que sur les mesures de diffusion (D) MD, (E) FA, et (F) cartes paramétriques du flux sanguin. Figure reproduite de Sheng et al. (Sheng, 2019) sous la Creative Commons Attribution License.
L'imagerie pondérée par la susceptibilité (SWI) et la cartographie quantitative de la susceptibilité (QSM), plus gourmande en calculs, peuvent quantifier les éléments traces paramagnétiques, tels que le fer dans la ferritine, l'hème désoxygéné dans le sang, le calcium diamagnétique et, en raison des déplacements locaux de la susceptibilité magnétique du diamagnétisme des protéines et des lipides, elles peuvent également quantifier la myéline et l'anisotropie microstructurale de la matière blanche (Wiggermann, 2017; Hametner, 2018). Dans des échantillons de cerveau ex vivo de patients atteints de SP, la QSM a identifié une accumulation de fer dans la microglie et les macrophages entourant les lésions chroniques actives et couvrantes, ainsi qu'une digestion active de la myéline pendant la formation des lésions (Wisnieff, 2015; Dal-Bianco, 2017). Une revue récente (Martire, 2022) a mis en évidence le fait que les lésions de bordure paramagnétiques (PRLs) sont : (1) spécifiques des lésions de SP, (2) associées à des résultats cliniques plus mauvais, et (3) prédictives de la conversion à la SP rémittente (RRMS) avec une grande précision.
Notre équipe se fera un plaisir de répondre à vos questions sur les lésions améliorées par le gadolinium dans les essais cliniques sur la sclérose en plaques ou de vous fournir des informations spécifiques sur nos autres services d'imagerie.
Découvrez nos services d'imagerie
Contenu connexe
Biomarqueurs de neuro-imagerie pour la sclérose tubéreuse de Bourneville (STB)
Aperçu des biomarqueurs d'IRM et d'imagerie pondérée en diffusion pour évaluer l'efficacité des traitements neurologiques dans les essais cliniques de la STB.
La neuroimagerie dans la démence frontotemporale et les essais cliniques
L'utilité des biomarqueurs d'imagerie IRM et TEP dans notre compréhension des variantes de la démence frontotemporale (DFT) et leur utilisation comme critères d'évaluation dans les essais cliniques sur la DFT.
Biomarqueurs d'imagerie pour distinguer la CBD des autres tauopathies
Vue d'ensemble des biomarqueurs d'imagerie cérébrale permettant d'identifier les sujets atteints de dégénérescence corticobasale (CBD) et de leur utilisation dans le cadre d'essais cliniques de traitements modificateurs de la maladie.
Biomarqueurs d'imagerie pour la paralysie supranucléaire progressive (PSP)
Aperçu des différentes méthodes d'imagerie cérébrale (IRM, PET, SPECT) disponibles pour évaluer l'efficacité des traitements de fond dans les essais cliniques sur la PSP.
Évolution longitudinale de la TEP Tau dans la MCI et la maladie d'Alzheimer
Vue d'ensemble de l'histoire naturelle de l'évolution de l'absorption et de la fixation du traceur de la TEP Tau dans les troubles cognitifs légers (MCI) et la maladie d'Alzheimer (AD).
L'IRM dans les essais cliniques sur l'atrophie du système multiple (MSA)
Cette ressource donne un aperçu de l'utilité de l'IRM volumétrique et de l'imagerie pondérée en diffusion (DWI) en tant que biomarqueurs dans les études de recherche sur la MSA.