Pourquoi utiliser la neuroimagerie dans les essais cliniques sur la PSP?
Les modalités de la neuro-imagerie peuvent être utilisées pour interroger de manière non invasive les changements structurels, fonctionnels et moléculaires qui se produisent dans le cerveau des patients atteints de la PSP (De Natale, 2023). Dans les essais cliniques, l'imagerie cérébrale peut servir à améliorer la sélection des patients, à surveiller la sécurité, ainsi qu'à suivre la progression de la maladie et les effets potentiels du traitement (Whitwell, 2023).
Stratégie d'imagerie multimodale pour les essais cliniques sur la PSP
L'utilisation de la neuro-imagerie dans les essais cliniques implique de nombreuses considérations importantes pour garantir des résultats précis, fiables et significatifs. Le choix de la modalité d'imagerie est crucial, l'imagerie structurelle (par exemple l'IRM) étant utilisée pour la neuroanatomie détaillée et l'imagerie de médecine nucléaire (par exemple SPECT, PET) pour évaluer l'activité cérébrale, les changements métaboliques et les informations moléculaires. La normalisation des protocoles d'imagerie et un contrôle de qualité rigoureux sont essentiels pour maintenir la cohérence entre les différents sites et les différents moments. La neuro-imagerie facilite la sélection des patients en identifiant les participants appropriés grâce à des biomarqueurs spécifiques, ce qui permet d'obtenir des populations d'étude plus homogènes et d'effectuer une stratification en fonction du stade de la maladie, de sa gravité et/ou des profils des biomarqueurs. Le suivi de l'évolution de la maladie et des effets du traitement est facilité par les scanners de référence et de suivi, qui permettent de suivre les changements longitudinaux de la structure et de la fonction cérébrales et des marqueurs moléculaires au fil du temps. Les biomarqueurs d'imagerie fournissent des indicateurs précoces de la réponse au traitement, ce qui permet d'évaluer l'efficacité avant que les symptômes cliniques ne changent. En outre, la neuro-imagerie améliore la surveillance de la sécurité en détectant les effets indésirables du traitement sur la structure et la fonction du cerveau.
Les biomarqueurs d'imagerie utilisés pour évaluer la PSP comprennent la volumétrie structurelle par IRM pour évaluer l'atrophie régionale dans l'ensemble du cerveau, en particulier le mésencéphale, l'épaisseur corticale pour évaluer l'atrophie de la matière grise du cortex, l'IRM de diffusion pour évaluer la matière blanche et les changements structurels, l'IRM de la neuromélanine pour évaluer les changements structurels et moléculaires dans le mésencéphale, la TEP tau pour quantifier l'accumulation d'espèces tau pathologiques, et la SPECT DaTscan ou la TEP DaT pour identifier les changements dans la densité des terminaisons dopaminergiques.
Normalisation des protocoles et procédures de neuro-imagerie
L'harmonisation des protocoles et des procédures d'acquisition, de traitement et d'analyse des images permet de garantir la cohérence et la fiabilité des sites d'imagerie et des études. Des aspects clés doivent être pris en compte lors des phases d'acquisition et de traitement/analyse des images d'une étude de recherche.
Acquisition d'images
Paramètres d'imagerie
- Normaliser les paramètres de l'IRM tels que l'intensité du champ (par exemple 1,5T, 3T), les types de séquences (par exemple pondérées en T1, pondérées en T2, imagerie pondérée en diffusion), l'épaisseur des coupes et la taille des voxels.
- Normaliser le type de radiotraceurs, la dose injectée et le calendrier des scanners après l'injection.
Procédures de balayage
- Assurer un positionnement cohérent du patient afin d'éviter toute variabilité dans l'acquisition des images.
- Normaliser les préparations préalables à la scintigraphie, telles que le jeûne pour la TEP ou l'utilisation d'agents de contraste pour l'IRM.
Formation et certification des sites
- Former et certifier le personnel de tous les sites pour qu'il suive des protocoles normalisés, afin d'assurer la cohérence de l'acquisition et du traitement des images.
- Utiliser des scanners fantômes (objets standardisés aux propriétés connues) pour contrôler régulièrement les performances des scanners. Cette stratégie permet de détecter et de corriger tout écart par rapport aux performances attendues.
Traitement et analyse d'images
Contrôle de la qualité (CQ)
- Le contrôle de la qualité garantit l'intégrité et la cohérence des données de neuro-imagerie tout au long de l'étude.
- Contrôlez en temps réel la qualité de l'image pendant l'acquisition afin d'identifier et de résoudre immédiatement les problèmes, tels que les mouvements du patient ou d'autres artefacts, et incluez des scans répétés dans les protocoles.
- Utiliser des contrôles de qualité automatisés et manuels après l'acquisition et le traitement pour évaluer la qualité de l'image source et la qualité du traitement de l'image.
Méthodes de quantification
- Une quantification précise et fiable des données de neuro-imagerie est essentielle pour une analyse significative dans les essais cliniques.
- Normaliser les étapes de prétraitement, telles que la correction du mouvement, la normalisation spatiale et la normalisation de l'intensité, afin de garantir la comparabilité des données.
- Utiliser des algorithmes validés pour la segmentation des tissus cérébraux (par exemple, matière grise, matière blanche, LCR) et l'enregistrement des images dans un espace anatomique normalisé.
Fiabilité test-retest
- Réaliser des études test-retest pour évaluer la fiabilité des mesures d'imagerie. Cette approche consiste à scanner les mêmes participants plusieurs fois dans les mêmes conditions et à évaluer la cohérence des résultats.
Quels biomarqueurs IRM peuvent être utilisés pour évaluer l'évolution longitudinale de la PSP?
L'atrophie du mésencéphale est la caractéristique classique de la PSP, traditionnellement identifiée par le signe du colibri dans la partie supérieure du mésencéphale (Groschel, 2006), l'aspect Mickey Mouse (Page, 2020) du diamètre de la ligne médiane antéro-postérieure du mésencéphale au niveau du colliculus supérieur, et le signe de la gloire du matin comme une perte du bord convexe latéral du tegmentum du mésencéphale (Adachi, 2004).Ces caractéristiques peuvent être quantifiées en évaluant les changements de volume dans les structures sous-corticales, en particulier l'atrophie du mésencéphale, du pons et du pédoncule cérébelleux supérieur (SCP), ainsi que l'élargissement simultané des ventricules.
Les modifications structurelles du cerveau peuvent être quantifiées à l'aide de mesures planimétriques, telles que le rapport mésencéphale-péron ou l'indice de parkinsonisme par résonance magnétique (MRPI) et le MRPI 2.0 amélioré (Quattrone, 2018). Des études longitudinales ont utilisé les changements dans les mesures MRPI pour suivre les changements dans la taille et la forme du mésencéphale et pour surveiller la progression de la maladie (Picillo, 2020). Sjostrom et al. ont étendu ces travaux pour décrire l'utilisation d'évaluations 3D du volume du mésencéphale, qui donnent de meilleurs résultats que les mesures planimétriques pour séparer les patients atteints de PSP de ceux atteints de PD (Sjostrom, 2020).
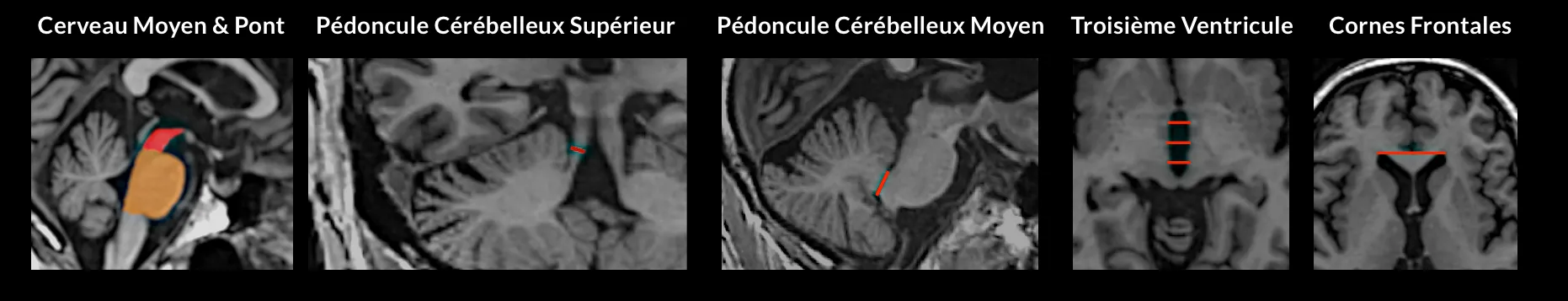
L'atrophie du mésencéphale peut être quantifiée par des mesures planimétriques du mésencéphale, en particulier par l'indice de parkinsonisme par résonance magnétique (MRPI). Illustré sur un patient PSP individuel, les volumes sont des régions remplies et les largeurs sont des lignes rouges. MRPI = [(P/M) x (MCP/SCP)], où P = surface du pons dans le plan midsagittal (région rouge), M = surface du mésencéphale dans le plan midsagittal (région brune), MCP = largeur moyenne des pédoncules cérébelleux moyens, SCP = largeur moyenne des pédoncules cérébelleux supérieurs. L'IPMR 2.0 actualisé = IPMR x (V3 / FH), où V3 = largeur moyenne (à partir de trois mesures) du troisième ventricule sur une image axiale au niveau des commissures antérieure et postérieure, et FH = largeur maximale de la corne frontale gauche à droite sur une image axiale dans le plan de la commissure antérieure à postérieure.
De nombreux biomarqueurs IRM ont été largement utilisés pour identifier et diagnostiquer les patients atteints de PSP (Oba, 2005), ainsi que pour aider à suivre la progression de la maladie (Picillo, 2020), et peuvent être utilisés de manière longitudinale pour évaluer l'efficacité des interventions thérapeutiques (Whitwell, 2017).
Changements volumétriques dans les structures sous-corticales
Messina et al. (Messina, 2011) et d'autres ont identifié que l'atrophie du thalamus ne se produit que chez les sujets PSP, tandis qu'une hypertrophie significative a été observée dans le système ventriculaire des sujets PSP et MSA-P (Whitwell, 2007; Messina, 2011; Albrecht, 2019). Cette observation illustre la capacité de la volumétrie structurelle à différencier les sujets PSP des autres formes de parkinsonisme. Whitwell et al. ont également démontré que l'atrophie longitudinale du mésencéphale est en corrélation avec la progression du score clinique de la PSP (Whitwell, 2019). D'autres aspects de la progression clinique, tels que l'aggravation des résultats des tests de langage et de fluidité, ont été corrélés à l'atrophie du caudé (Agosta, 2010), et il a été démontré que l'atrophie du putamen était associée à l'apathie et aux troubles du comportement chez les patients atteints de la PSP (Josephs, 2008).
Épaisseur corticale
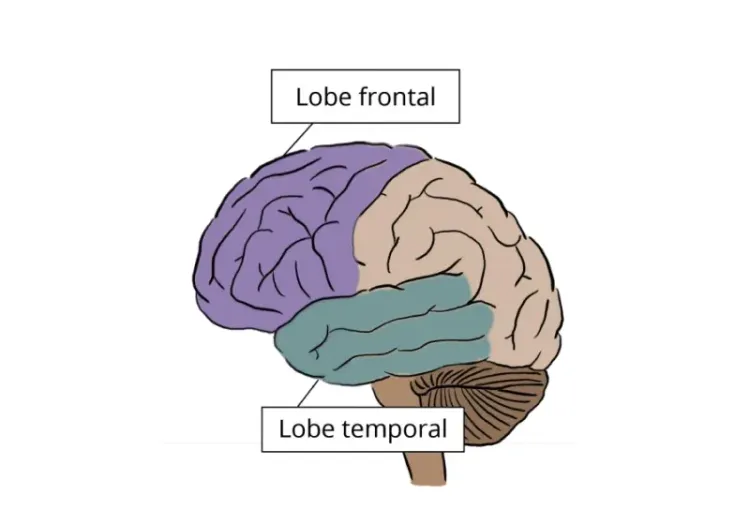
Il a été démontré que l'atrophie corticale, principalement dans les lobes frontaux et temporaux, permet de différencier les patients atteints de CBD de ceux atteints de PSP (Whitwell, 2007). Whitwell et ses collègues ont également montré que les mesures de l'épaisseur corticale permettent de distinguer les différentes formes de PSP et de suivre de manière fiable l'évolution de la maladie dans le temps (Whitwell, 2019). En utilisant la morphométrie basée sur le voxel (VBM), Agosta et al. ont donné un aperçu des modèles spécifiques d'atrophie corticale et sous-corticale associés à la PSP, aidant à la différencier d'autres troubles neurodégénératifs (Agosta, 2010).
Diffusion (DTI)
L'ITD peut évaluer les changements microstructuraux dans les voies de la substance blanche. Agosta et al. ont montré que les lésions des voies de la substance blanche influencent les symptômes moteurs, cognitifs et comportementaux de la PSP (Agosta, 2014). Cette étude conclut que l'ITD a une sensibilité et une spécificité élevées pour le diagnostic des troubles du mouvement, et peut faciliter le diagnostic précoce ainsi que la différenciation et la sous-catégorisation de la PSP et d'autres troubles du mouvement.
Imagerie de la neuromélanine et du fer
Les séquences IRM avancées sensibles à la neuromélanine et aux dépôts de fer, telles que l'imagerie pondérée par la susceptibilité (SWI) ou la cartographie quantitative de la susceptibilité (QSM), peuvent suivre les changements dans l'accumulation de fer dans les régions touchées par la PSP (Mazzucchi, 2019). Il a été démontré que la zone de la substantia nigra sensible à la neuromélanine et le volume du mésencéphale sont significativement plus petits chez les patients atteints de la PSP que chez les patients atteints de la maladie de Parkinson et les témoins. Taniguchi et al. ont montré que la précision diagnostique était améliorée lorsque l'analyse IRM sensible à la neuromélanine était ajoutée à l'analyse volumétrique (Taniguchi, 2018). Ainsi, la combinaison de l'IRM sensible à la neuromélanine et de la volumétrie du cerveau moyen peut être utile pour différencier la PSP de la PD.
Quels biomarqueurs d'imagerie cérébrale PET et SPECT ont été évalués pour la PSP?
Les biomarqueurs d'imagerie TEP sont largement utilisés pour évaluer la PSP (Strobel, 2023). L'imagerie TEP de la tau est particulièrement pertinente pour la PSP, une tauopathie 4R (Saint-Aubert, 2017; Jin, 2023; Mena, 2023). Des traceurs tels que le [11C]PBB3, le [18F]THK-5351 (Ishiki, 2017; Harada 2016) et le [18F]AV-1451 (flortaucipir) (Mena, 2023) sont utilisés pour visualiser et quantifier la pathologie tau dans le cerveau, en particulier dans des régions telles que le globus pallidus, le mésencéphale et le cortex frontal.
Madetko-Alster et al. ont montré qu'un mauvais contrôle de la glycémie avec une forte variabilité glycémique est en corrélation avec une atrophie accrue du lobe temporal médian chez les patients atteints de PSP et de CBS, avec une aggravation concomitante des performances cognitives (Madetko-Alster, 2024). Cette étude a mis en évidence l'importance du métabolisme du glucose chez les patients atteints de PSP et de CBS. La TEP au [18F]-2-fluoro-2-désoxyglucose (FDG) est utilisée pour évaluer le métabolisme du glucose dans le cerveau. Dans la PSP, des réductions significatives du métabolisme du glucose sont souvent observées dans le mésencéphale, les régions frontales et préfrontales (Black, 2024).
Le [11C]PK11195 est un radiotraceur qui se lie à la protéine translocatrice (TSPO) exprimée dans la microglie activée, ce qui permet de visualiser la neuroinflammation. Des études utilisant le [11C]PK11195 ont identifié une augmentation de la liaison dans le thalamus, le putamen et le pallidum en comparant les patients atteints de la PSP à des témoins sains, et montrent des corrélations significatives entre la liaison du marqueur neuroinflammatoire et à la fois les performances cognitives et la gravité de la maladie (Strobel, 2023). Il existe également des indications d'une corrélation statistiquement significative entre la liaison du [11C]PK11195 et le radiotraceur tau [18F]AV-1451 (Strobel, 2023), illustrant la relation entre l'accumulation accrue de tau et la neuroinflammation.
Les patients atteints de PSP présentent généralement des réductions généralisées et symétriques de la liaison DatScan. Une récente analyse DatScan comparant la MP et le parkinsonisme atypique (CBD, MSA-P et PSP) montre que le DaTscan peut aider à différencier la CBD de la PSP, bien que le DaTscan ne permette pas de différencier clairement la MP, la MSA-P et la PSP (Constantinides, 2023).
Notre équipe se fera un plaisir de répondre à vos questions sur les biomarqueurs d'imagerie pour la paralysie supranucléaire progressive ou de vous fournir des informations spécifiques sur nos autres services d'imagerie.
Découvrez nos services d'imagerie
Contenu connexe
Informations actualisées sur les meilleures pratiques liées à l'utilisation de la neuroimagerie dans les essais cliniques sur les maladies neurologiques.
IRM de diffusion et démence frontotemporale (DFT)
Analyse de la neuroimagerie de diffusion à partir de l'étude FTLDNI sur l'histoire naturelle de la démence frontotemporale (DFT)
Démence frontotemporale (DFT) et atrophie cérébrale par IRM
Biomarqueurs IRM (y compris l'atrophie cérébrale) issus des études FTLDNI sur l'histoire naturelle de la démence frontotemporale (DFT).
IRM et dégénérescence corticobasale (CBD)
Mesures longitudinales de l'atrophie cérébrale par IRM provenant des études 4RTNI et FTLDNI, y compris le calcul de la taille des échantillons pour les essais cliniques sur la dégénérescence corticobasale.
La neuroimagerie dans la démence frontotemporale et les essais cliniques
L'utilité des biomarqueurs d'imagerie IRM et TEP dans notre compréhension des variantes de la démence frontotemporale (DFT) et leur utilisation comme critères d'évaluation dans les essais cliniques sur la DFT.
Essais cliniques sur les lésions renforcées par le gadolinium en IRM dans la SP
Comment les lésions rehaussées par le gadolinium (Gd) sont utilisées pour suivre la progression de la maladie et la réponse à l'intervention thérapeutique dans les essais cliniques sur la sclérose en plaques (SP).
Évolution longitudinale de la TEP Tau dans la MCI et la maladie d'Alzheimer
Vue d'ensemble de l'histoire naturelle de l'évolution de l'absorption et de la fixation du traceur de la TEP Tau dans les troubles cognitifs légers (MCI) et la maladie d'Alzheimer (AD).
Biomarqueurs d'imagerie pour distinguer la CBD des autres tauopathies
Vue d'ensemble des biomarqueurs d'imagerie cérébrale permettant d'identifier les sujets atteints de dégénérescence corticobasale (CBD) et de leur utilisation dans le cadre d'essais cliniques de traitements modificateurs de la maladie.
L'IRM dans les essais cliniques sur l'atrophie du système multiple (MSA)
Cette ressource donne un aperçu de l'utilité de l'IRM volumétrique et de l'imagerie pondérée en diffusion (DWI) en tant que biomarqueurs dans les études de recherche sur la MSA.