Quelles sont les complexités du diagnostic clinique et de la protéinopathie (Tau vs. TDP-43) dans la DFT?
Sous-types de DFT
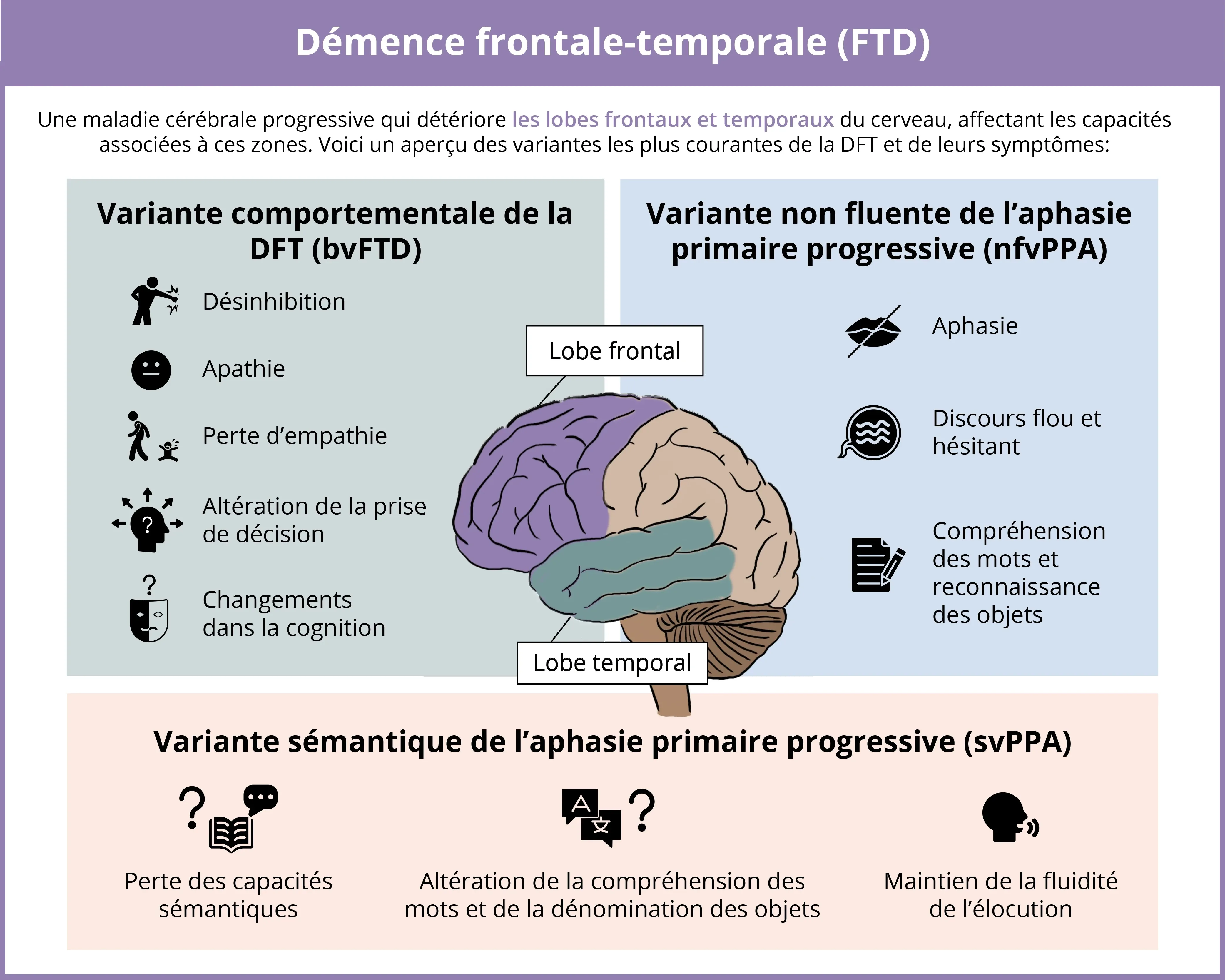
La démence frontotemporale (DFT) est un groupe de troubles neurodégénératifs progressifs et hétérogènes (sur le plan clinique et pathologique) caractérisés par une dégénérescence des lobes frontaux et temporaux du cerveau. Les trois principaux sous-types cliniques sont la variante comportementale de la DFT (bvFTD), la variante non fluente de l'aphasie primaire progressive (nfvPPA) et la variante sémantique de l'aphasie primaire progressive (svPPA). La bvFTD est le sous-type de DFT le plus répandu, représentant environ 70 % des cas (Hogan, 2016; Leroy, 2021). Les principaux symptômes cliniques de la DFTv incluent des changements comportementaux, tels que la désinhibition, l'apathie et l'altération de la cognition sociale (Rascovsky, 2011). En revanche, la nfvPPA et la svPPA sont moins répandues, la nfvPPA représentant environ 25 % des cas. La nfvPPA et la svPPA altèrent différemment les processus de la parole et du langage (Gorno-Tempini, 2011). Plus précisément, la nfvPPA est liée à une utilisation incorrecte de la grammaire ou de la syntaxe et à des déficits d'élocution, le discours devenant progressivement non fluent, et peut entraîner le mutisme. En revanche, la svPPA se caractérise par une altération de la compréhension sémantique, en particulier pour les mots isolés, alors que la production vocale n'est généralement pas altérée (Gorno-Tempini, 2011).
Cliquez pour copier le lien
Complexité du diagnostic clinique
La DFT est la deuxième cause de démence précoce après la maladie d'Alzheimer (MA), représentant environ 10 % des cas de démence chez les personnes âgées de moins de 65 ans (Hogan, 2016). Toutefois, ces estimations peuvent être inexactes car la DFT est souvent mal diagnostiquée ou diagnostiquée plus tard qu'elle ne devrait l'être. Cette ambiguïté est largement due au fait que le diagnostic de DFT dépend de la détection des caractéristiques cliniques. L'hétérogénéité des symptômes cliniques de la DFT et leur chevauchement avec ceux de divers troubles psychiatriques rendent le diagnostic de la DFT difficile. En particulier, les symptômes cliniques de la DFTB, notamment l'apathie, peuvent facilement être interprétés à tort comme une dépression, ce qui accroît le risque d'erreur de diagnostic chez les patients atteints de DFTB (Tsoukra, 2022). En outre, les pathologies génétiques et moléculaires associées à la DFT recoupent celles d'autres troubles neurologiques, tels que la paralysie supranucléaire progressive (PSP), la dégénérescence corticobasale (CBD) et la sclérose latérale amyotrophique (SLA). Par conséquent, l'identification de biomarqueurs spécifiques à la maladie, tels que les marqueurs de neuro-imagerie, est cruciale pour parvenir à un diagnostic plus précoce et plus précis. Par exemple, les biomarqueurs d'atrophie IRM ont montré des tailles d'effet significatives et représentent un pourcentage considérable de la variance de la fonction clinique, ce qui soutient leur utilisation comme mesures de résultats et pour la classification des patients dans les essais cliniques (Staffaroni, 2019). En outre, les progrès récents de l'imagerie TEP avec des radioligands spécifiques, notamment ceux qui se lient à la protéine tau et à la protéine TDP-43, faciliteront la mise au point de traitements de fond de la DFT, actuellement indisponibles, et permettront des interventions plus précoces, au moment où elles peuvent être les plus efficaces.
Caractéristiques neuropathologiques
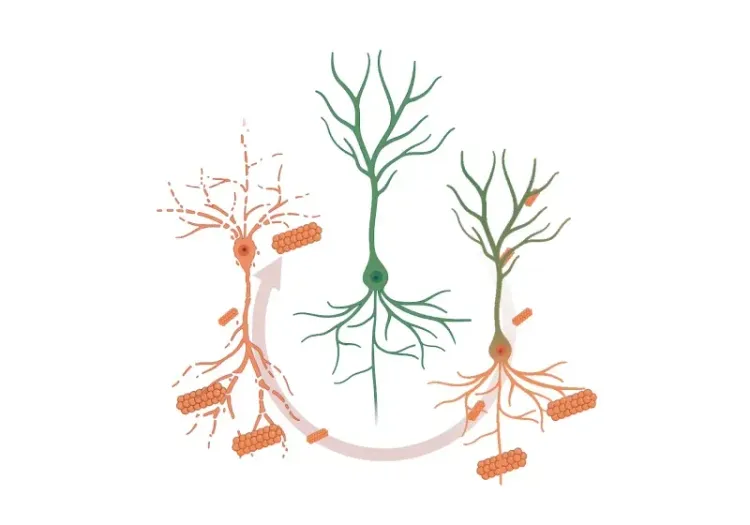
Le processus pathologique fondamental qui sous-tend la DFT est la dégénérescence lobaire fronto-temporale (DLFT), caractérisée par une neurodégénérescence et une atrophie cérébrale associée, ainsi que par une gliose dans les lobes frontaux et temporaux (Hernandez, 2018). La FTLD peut être classée en trois sous-types principaux identifiés post-mortem : FTLD-tau, FTLD-TDP et FTLD-FUS. Ces sous-types se distinguent par l'agrégation spécifique de protéines mal repliées dans les neurones et les cellules gliales, impliquant principalement la protéine tau, la protéine de liaison à l'ADN de la réponse transactive de 43 kDa (TDP-43) et la protéine fusionnée dans le sarcome (FUS) (Liu, 2019).
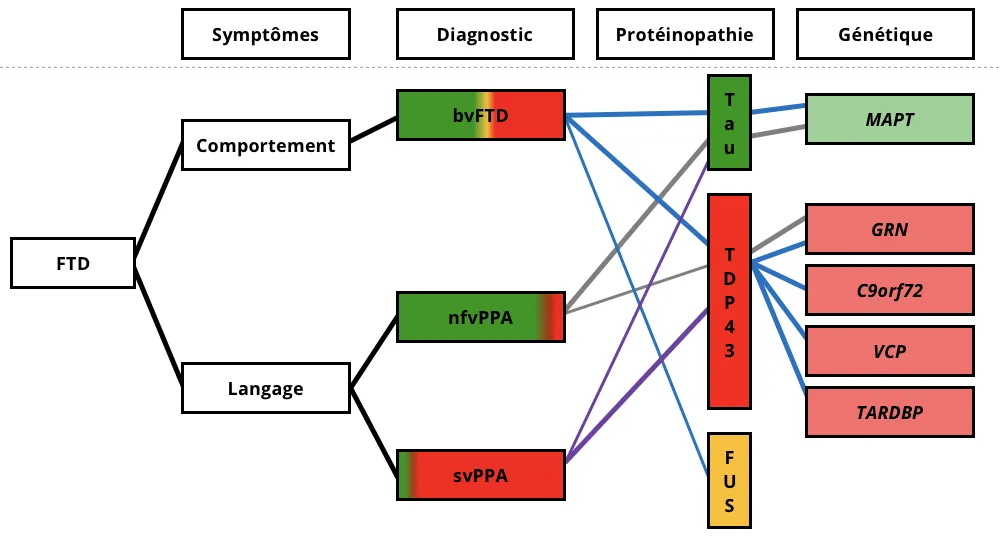
Les associations cliniques, pathologiques et génétiques pour les trois variantes de la DFT. Les symptômes cliniques sont représentés à gauche, les régions colorées du diagnostic clinique représentant les pourcentages relatifs de patients présentant chaque protéinopathie neuropathologique sous-jacente. Les lignes colorées relient les caractéristiques cliniques, pathologiques et génétiques associées. bvFTD, behavioral-variant frontotemporal dementia ; svPPA, semantic-variant primary progressive aphasia ; nfvPPA, non-fluent variant primary progressive aphasia ; FUS, fused in sarcoma ; TDP-43, protéine de 43 kDa liant l'ADN à la réponse transactive (TAR) ; C9orf72, cadre de lecture ouvert 72 du chromosome 9 ; GRN, mutations de la progranuline ; MAPT, protéine tau associée aux microtubules ; et VCP, protéine contenant de la valosine. Figure reproduite d'après Liu et al. (Liu, 2019) sous la Creative Commons Attribution License.
Il est intéressant de noter qu'il n'existe pas de corrélation directe entre les sous-types de FTLD et le diagnostic clinique. Par exemple, environ 50 % des cas de bvFTD présentent des inclusions intracellulaires de TDP-43, tandis qu'environ 40 % sont associés à une pathologie tau (Chare, 2014; Mann, 2017). Si la plupart des cas de DFT sont sporadiques, environ 30 % ont des antécédents familiaux de démence. Parmi les cas héréditaires, environ 60 % présentent des protéinopathies spécifiques, telles que les mutations MAPT liées à la FTLD-tau et les mutations C9orf72, GRN, VCP et TARDBP associées à la FTLD-TDP (Le Ber, 2013).
La FTLD-tau représente environ 40 % des cas de FTLD et se caractérise par l'agrégation anormale de la protéine tau dans les cellules neuronales et/ou gliales. La pathologie tau dans les formes génétiques de DFT liées à des mutations MAPT est hétérogène, la plupart des cas présentant une pathologie tau à 4 répétitions (4R), et certains cas formant des enchevêtrements neurofibrillaires similaires à ceux trouvés dans la maladie d'Alzheimer (Levy, 2022). Les tauopathies sont également associées à divers autres troubles neurodégénératifs, dont la CBD et la PSP. La FTLD-tau est couramment observée dans environ 40 % des cas de bvFTD et dans la plupart des cas de nfvPPA, mais elle est rare dans la svPPA.
La FTLD-TDP constitue environ 50 % des cas de FTLD, ce qui en fait le sous-type le plus courant. La TDP-43, une protéine nucléaire impliquée dans le saut d'exon et la régulation de la transcription, devient ubiquitinée et s'agrège au cytoplasme dans les états pathologiques, formant des inclusions cytoplasmiques (Neumann, 2006). La pathologie TDP-43 est également présente chez la plupart des patients atteints de SLA (Neumann, 2013). La FTLD-TDP comporte quatre sous-types pathologiques primaires plus étroitement liés à leurs formes génétiques qu'à leurs phénotypes cliniques : Le type A est associé aux mutations du gène GRN et lié à la bvFTD et à la nfvPPA ; le type B est associé aux mutations du gène C9orf72 et lié à la bvFTD et à la SLA ; le type C est lié à la plupart des cas de svPPA ; et le type D est associé aux mutations du gène VCP et lié à la bvFTD et à la SLA (Neumann, 2021). Les récentes avancées dans le domaine des traceurs d'imagerie TEP TDP-43 sont prometteuses pour améliorer le diagnostic et le traitement de la FTLD-TDP (Cordts, 2023; Seredenina, 2023).
La FTLD-FUS est le sous-type le plus rare, représentant environ 5 à 10 % des cas de FTLD. Elle se caractérise par le dépôt de la protéine FUS et peut se présenter sous la forme d'une bvFTD sporadique à début précoce, marquée par des symptômes neuropsychiatriques sévères et rapidement progressifs. Des mutations du gène FUS, qui code pour la protéine FUS, sont également impliquées dans la SLA (Vance, 2009).
Quels biomarqueurs d'imagerie peuvent être utilisés pour distinguer les sous-types de DFT et/ou distinguer la DFT de la MA?
La spécificité et la sensibilité du diagnostic de la DFT peuvent être considérablement améliorées par l'utilisation de biomarqueurs d'imagerie, tels que l'imagerie par résonance magnétique (IRM) et la tomographie par émission de positons (TEP). En plus de ces techniques, les modalités d'IRM telles que l'imagerie du tenseur de diffusion (DTI) et le marquage du spin artériel (ASL) sont efficaces pour diagnostiquer la DFT en évaluant l'intégrité de la substance blanche et en quantifiant la perfusion cérébrale, respectivement ; cependant, la spécificité et la sensibilité de ces techniques peuvent varier (Zhang, 2013; Ono, 2016; Tosun, 2016; Watanabe, 2021). Ces méthodes d'imagerie sont des outils précieux pour identifier les changements cérébraux associés à la DFT, ce qui permet un diagnostic plus précoce et plus précis. Les études longitudinales des changements cérébraux peuvent également fournir des mesures de résultats significatives pour les essais cliniques. Il est essentiel de différencier les sous-types de DFT et de distinguer la DFT des autres démences, telles que la MA, pour obtenir un diagnostic, un pronostic et un traitement précis, ainsi qu'une classification adéquate dans les essais cliniques.
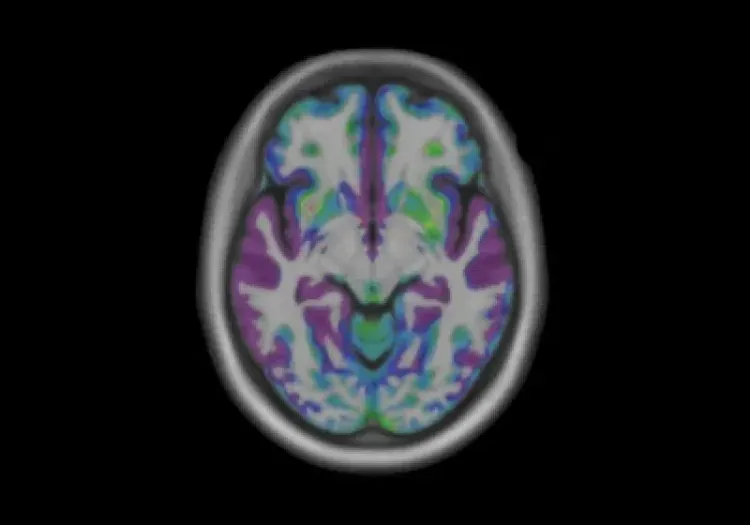
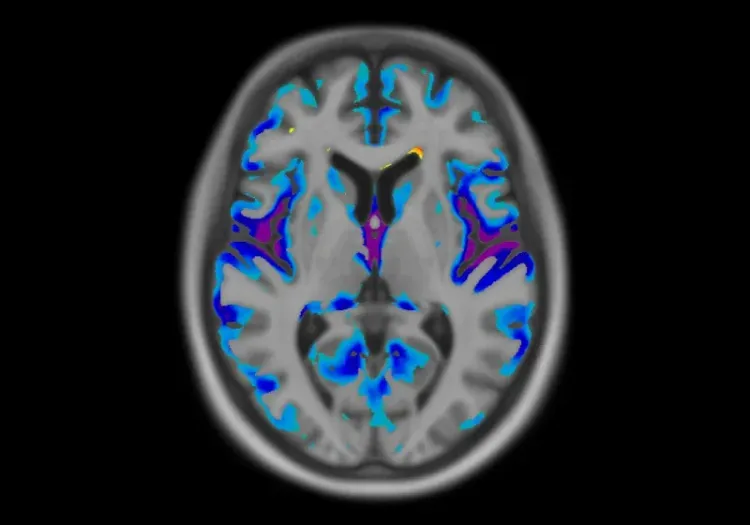
L'IRM est un outil important pour étudier les schémas d'atrophie associés à la DFT, ce qui permet de les différencier d'autres démences, comme la MA. En général, la DFT présente une atrophie dans les lobes temporaux antérieurs et frontaux, tandis que la MA se caractérise par une atrophie généralisée, en particulier dans le lobe temporal médian (Bocti, 2006; Chouliaras, 2023). Un gradient d'atrophie antérieur-postérieur dans le lobe temporal indique une FTLD plutôt qu'une MA (Harper, 2014). En outre, la bvFTD est associée à une réduction du volume de matière grise dans le caudé, ce qui permet de la distinguer de la MA avec une précision de 79 % (Frings, 2014). Une étude explorant la relation entre les hyperintensités de la substance blanche (WMH) et l'atrophie de la substance grise a révélé que la DFT est plus étroitement liée à des changements dans les régions frontales et les ganglions de la base, contrairement aux régions insulaires et pariéto-occipitales qui affectent la MA (Dadar, 2021). Des études longitudinales par IRM ont montré que les volumes du cerveau entier et des ventricules peuvent être suivis de manière fiable sur une année, en corrélant les changements avec le déclin des mesures cliniques (Knopman, 2009). En outre, le déclin annuel du volume de matière grise dans le gyrus orbitofrontal latéral et dans la matière blanche temporale est plus prononcé dans la bvFTD que dans la MA, ce qui met en évidence des taux d'atrophie différents (Frings, 2014). Ensemble, ces résultats suggèrent que les schémas d'atrophie à l'IRM et les évaluations volumétriques longitudinales permettent de différencier efficacement la DFT de la MA, en associant la DFT à des réductions dans les lobes temporaux et frontaux antérieurs, ainsi que dans les structures sous-corticales, telles que les ganglions de la base.
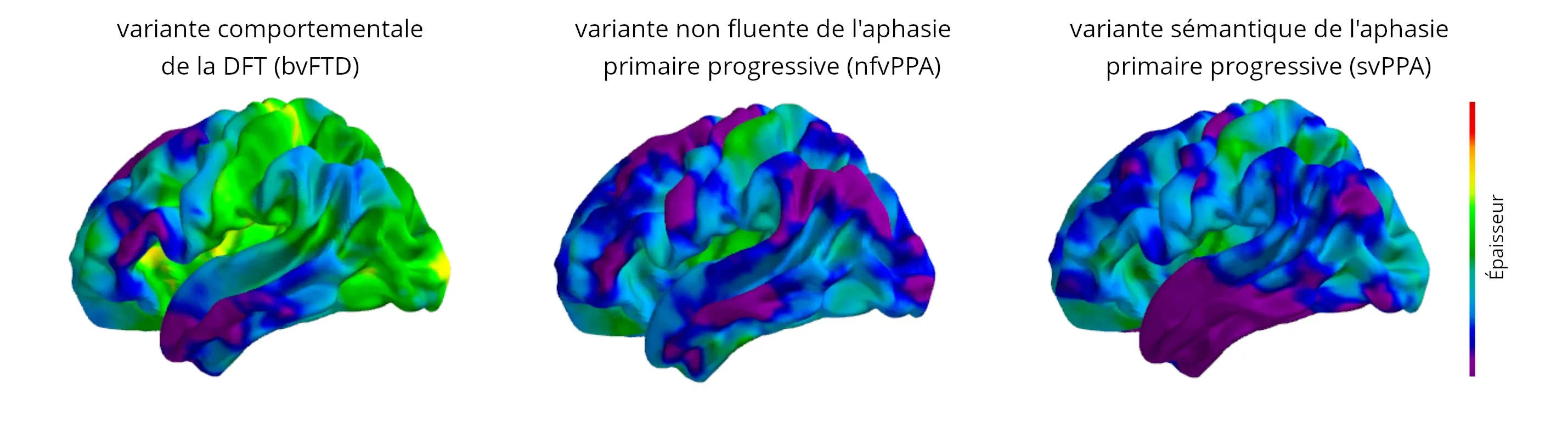
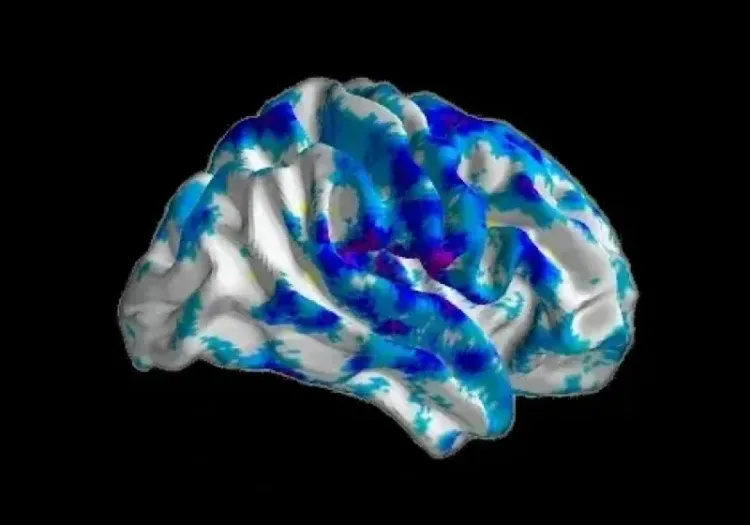
Les changements progressifs de l'épaisseur corticale sur une période de 12 mois sont illustrés pour chaque variante, démontrant les changements régionaux différentiels, avec l'atrophie la plus importante dans les couleurs violette et bleue (données générées par Biospective).
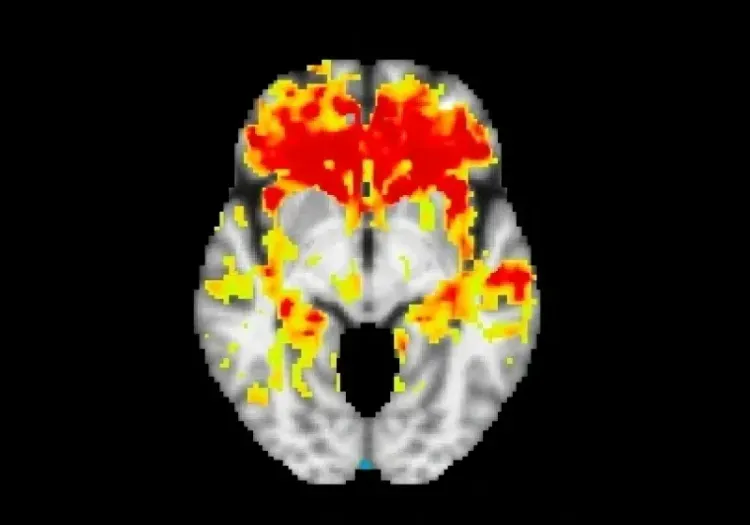
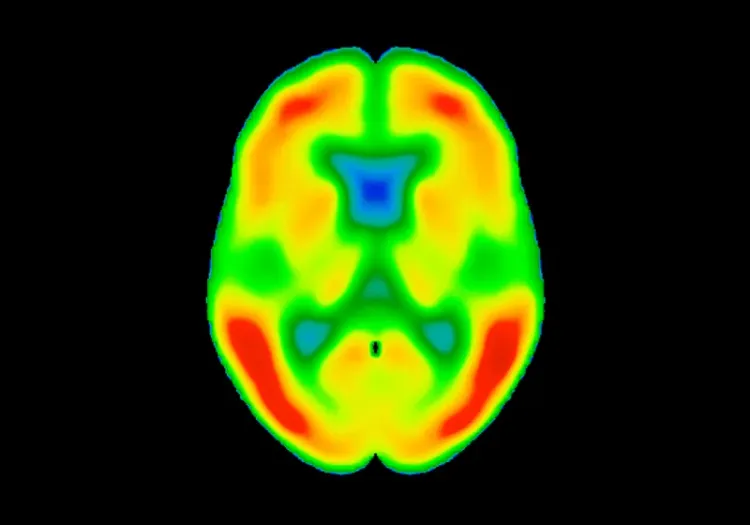
L'imagerie TEP au [18F]2-fluoro2-désoxyglucose (FDG) est particulièrement efficace pour diagnostiquer la DFT, avec une sensibilité et une spécificité élevées. Une étude comparative a montré que les examens SPECT/PET sont plus précis que l'IRM pour le diagnostic de la DFT (Mendez, 2007). La TEP au FDG distingue clairement la DFT de la MA, montrant un hypométabolisme temporo-pariétal postérieur diffus dans la MA et un hypométabolisme frontal et temporo antérieur focal dans la DFT (Mosconi, 2008; Gordon, 2016). L'utilisation de traceurs amyloïdes en TEP améliore encore la différenciation entre la DFT et la MA, renforçant le rôle de la pathologie amyloïde-β dans la MA tout en indiquant son absence dans la DFT (Hellwig, 2019). À l'inverse, la pathologie tau est présente à la fois dans la MA et dans la FTLD-tau, ainsi que dans d'autres maladies neurodégénératives (par exemple, la PSP et la CBD). Des études récentes utilisant l'imagerie TEP de la protéine tau ont montré des résultats prometteurs pour les patients atteints de DFT avec des mutations MAPT, révélant une liaison plus forte dans des régions telles que le lobe temporal inférieur droit, le putamen gauche, le lobe orbitofrontal médian gauche et l'hippocampe (Levy, 2022). Les progrès réalisés dans le domaine des ligands TEP ciblant la TDP-43 montrent également un potentiel d'amélioration de la précision du diagnostic et du développement du traitement de la FTLD-TDP (Seredenina, 2023).
Des schémas d'atrophie distincts sont observés dans les différents sous-types de DFT. Par exemple, la DFTv implique généralement une atrophie du lobe frontal, de l'insula antérieure et du cingulum antérieur, avec ou sans atrophie du lobe temporal. En revanche, la nfvPPA se caractérise par une atrophie périsylvienne gauche, affectant l'opercule temporal supérieur, insulaire et frontal, tandis que la svPPA présente généralement une atrophie temporale antérieure gauche, affectant particulièrement le pôle temporal et l'hippocampe (Galton, 2001; Antonioni, 2023; Tartaglia, 2023). La nfvPPA et la svPPA présentent toutes deux une atrophie asymétrique, avec des changements plus prononcés dans l'hémisphère gauche. Cependant, dans le cas de la svPPA, l'atrophie du lobe temporal gauche progresse plus rapidement, alors que dans le cas de la nfvPPA, c'est l'atrophie du lobe frontal gauche qui présente le taux de déclin le plus rapide (Rohrer, 2012).
La FTLD-tau et la FTLD-TDP présentent toutes deux une perte généralisée de matière grise frontale et temporale antérieure, mais la FTLD-tau est associée à une charge de morbidité relative de la matière blanche plus importante, comme le confirme la DTI (McMillan, 2013). En outre, les patients atteints de DFT avec des mutations GRN présentent un taux annuel d'atrophie du cerveau entier significativement plus élevé que ceux avec des mutations MAPT, ce qui suggère que les mutations GRN sont liées à une atrophie cérébrale plus étendue, alors que les mutations MAPT sont associées à une atrophie temporale antéro-médiane localisée (Whitwell, 2011). Inversement, les mutations C9orf72 sont associées à des taux plus faibles de déclin volumétrique par rapport aux mutations MAPT et GRN, bien que la variabilité clinique entre les patients puisse encore être significative (Gordon, 2016).
Notre équipe se fera un plaisir de répondre à vos questions sur la neuroimagerie de la démence frontotemporale et les essais cliniques ou de vous fournir des informations spécifiques sur nos autres services d'imagerie.
Découvrez nos services d'imagerie
Contenu connexe
Informations actualisées sur les meilleures pratiques liées à l'utilisation de la neuroimagerie dans les essais cliniques sur les maladies neurologiques.
Modélisation du mauvais repliement des protéines dans les maladies neurologiques
Modélisation informatique des mécanismes de mauvais repliement des protéines dans la neurodégénérescence et application à la découverte et au développement de traitements modificateurs de la maladie.
IRM de diffusion et démence frontotemporale (DFT)
Analyse de la neuroimagerie de diffusion à partir de l'étude FTLDNI sur l'histoire naturelle de la démence frontotemporale (DFT)
Démence frontotemporale (DFT) et atrophie cérébrale par IRM
Biomarqueurs IRM (y compris l'atrophie cérébrale) issus des études FTLDNI sur l'histoire naturelle de la démence frontotemporale (DFT).
IRM et dégénérescence corticobasale (CBD)
Mesures longitudinales de l'atrophie cérébrale par IRM provenant des études 4RTNI et FTLDNI, y compris le calcul de la taille des échantillons pour les essais cliniques sur la dégénérescence corticobasale.
Biomarqueurs d'imagerie pour distinguer la CBD des autres tauopathies
Vue d'ensemble des biomarqueurs d'imagerie cérébrale permettant d'identifier les sujets atteints de dégénérescence corticobasale (CBD) et de leur utilisation dans le cadre d'essais cliniques de traitements modificateurs de la maladie.
Biomarqueurs d'imagerie pour la paralysie supranucléaire progressive (PSP)
Aperçu des différentes méthodes d'imagerie cérébrale (IRM, PET, SPECT) disponibles pour évaluer l'efficacité des traitements de fond dans les essais cliniques sur la PSP.
Mesures IRM de la progression de la maladie pour les essais cliniques sur la PSP
Biomarqueurs IRM (y compris l'atrophie cérébrale) issus des études 4RTNI et FTLDNI sur l'histoire naturelle de la paralysie supranucléaire progressive (PSP).
Évolution longitudinale de la TEP Tau dans la MCI et la maladie d'Alzheimer
Vue d'ensemble de l'histoire naturelle de l'évolution de l'absorption et de la fixation du traceur de la TEP Tau dans les troubles cognitifs légers (MCI) et la maladie d'Alzheimer (AD).
L'IRM dans les essais cliniques sur l'atrophie du système multiple (MSA)
Cette ressource donne un aperçu de l'utilité de l'IRM volumétrique et de l'imagerie pondérée en diffusion (DWI) en tant que biomarqueurs dans les études de recherche sur la MSA.