Cette ressource décrit:
- Comment l'imagerie peut-elle être utilisée pour évaluer l'éligibilité, la sécurité et l'efficacité dans les essais cliniques sur la MSA?
- Quels biomarqueurs IRM peuvent être utilisés pour évaluer l'atrophie cérébrale dans la MSA?
- L'imagerie pondérée en diffusion (DWI) est-elle utile comme biomarqueur dans les études sur la MSA?
Comment l'imagerie peut-elle être utilisée pour évaluer l'éligibilité, la sécurité et l'efficacité dans les essais cliniques sur la MSA?
L'atrophie multisystémique (AMS) est une maladie neurodégénérative sporadique, rapidement progressive, apparaissant à l'âge adulte, qui se manifeste cliniquement par une combinaison variée de parkinsonisme, d'ataxie cérébelleuse et de dysfonctionnement autonome (Liu, 2024). Elle se caractérise pathologiquement par des inclusions cytoplasmiques contenant de l'alpha-synucléine anormalement agrégée dans les oligodendrocytes et les neurones (Liu, 2024). Sur la base des symptômes cliniques, la MSA peut être classée en un sous-type parkinsonien (MSA-P) et un sous-type cérébelleux (MSA-C). Selon les critères diagnostiques de la Movement Disorder Society (MDS) pour la MSA, le diagnostic de MSA cliniquement établi requiert la manifestation d'un dysfonctionnement autonome associé à un parkinsonisme peu sensible à la lévodopa et/ou à un syndrome cérébelleux (Zhang, 2023).
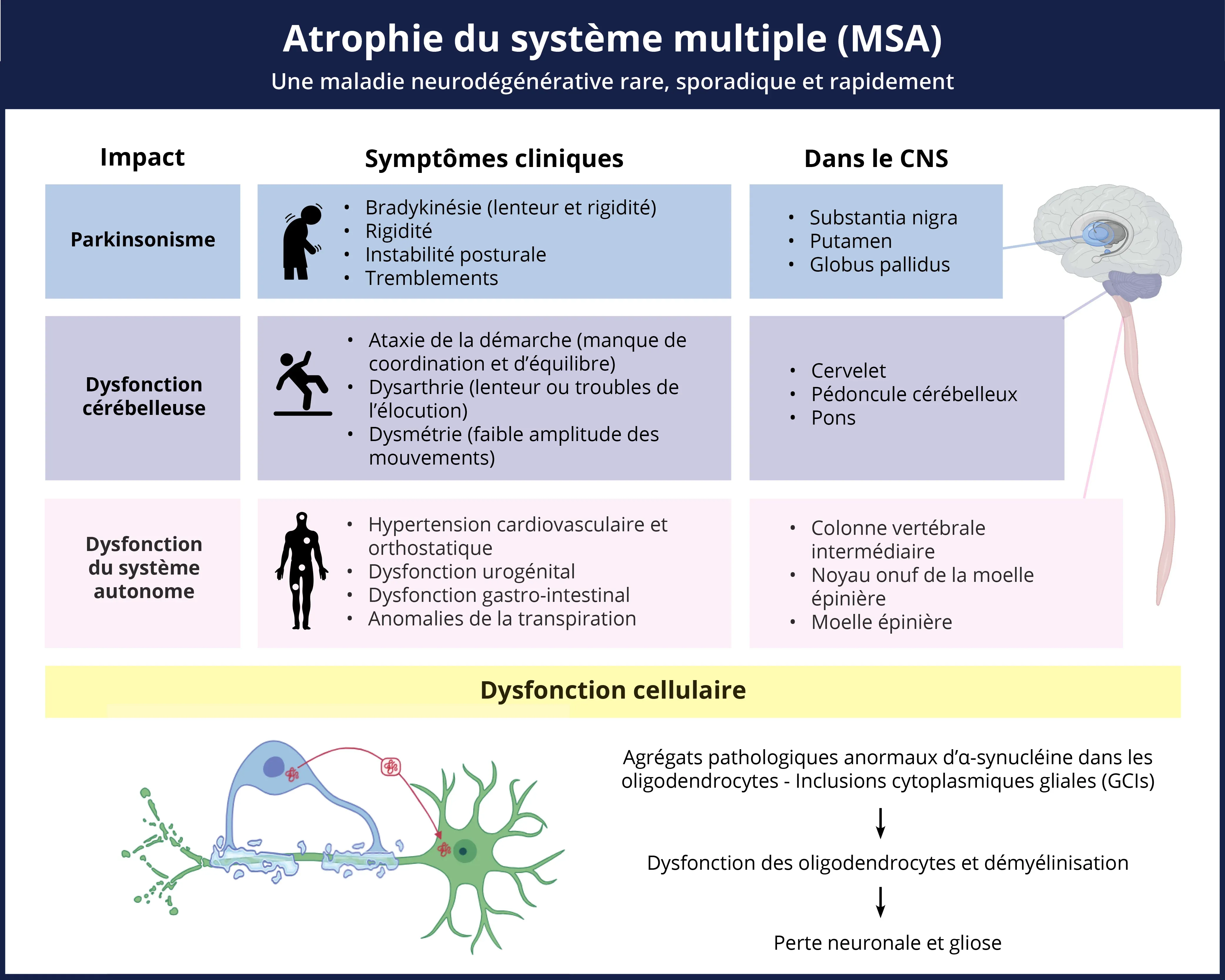
L'atrophie multisystémique (MSA) est une maladie complexe et rare qui se manifeste par une série de symptômes et de changements pathologiques dans l'ensemble du CNS.
Cliquez pour copier le lien
À ce jour, le diagnostic clair de la MSA par rapport à d'autres troubles parkinsoniens potentiels (maladie de Parkinson [MP] et paralysie supranucléaire progressive [PSP]) reste difficile. Le diagnostic définitif de la MSA ne peut être établi qu'avec la confirmation post-mortem de la présence d'inclusions cytoplasmiques gliales (GCIs) dans un schéma spatial bien défini (Chelban, 2019). Cependant, l'utilisation de plusieurs modalités d'IRM devient de plus en plus fiable pour obtenir des diagnostics plus précis que si l'on se fie uniquement aux scores d'évaluation clinique de la maladie (Quattrone, 2008). Une fois le diagnostic de MSA posé, la distinction entre les deux formes cliniques de la MSA peut déboucher sur un traitement plus ciblé et plus approprié. Actuellement, la faible sensibilité du diagnostic de la MSA exclut de nombreux patients des essais cliniques de thérapies potentielles de modification de la maladie. Par conséquent, un diagnostic plus précoce et plus précis grâce à des mesures d'imagerie pourrait accroître la participation à des essais qui changent la vie et ouvrir de nouvelles perspectives de recherche en identifiant des biomarqueurs plus précoces.
En outre, l'imagerie peut identifier d'autres signes cliniquement significatifs de maladies cérébrales malignes, ischémiques, hémorragiques, démyélinisantes, structurelles ou dégénératives qui ne sont pas associées à la MSA. Ce processus est essentiel pour identifier les problèmes potentiels qui pourraient compromettre la sécurité des patients au cours d'un essai clinique. Les critères de sécurité et d'éligibilité sont souvent recommandés comme critères d'inclusion dans les études cliniques et reposent largement sur les biomarqueurs d'imagerie. Toute indication d'un diagnostic alternatif, comme la PSP, la sclérose en plaques (SP), le parkinsonisme vasculaire et la maladie cérébelleuse symptomatique, doit être identifiée avec précision afin de garantir l'exclusion correcte des essais.
L'analyse longitudinale des données d'imagerie identifie des relations entre les résultats de l'IRM et la gravité ou la durée de la maladie chez les patients atteints de MSA (Kim, 2017). L'analyse quantitative d'images basée sur des images IRM, en particulier dans des régions d'intérêt spécifiques (ROI), peut évaluer l'efficacité des traitements de fond chez les patients atteints de MSA. Des recherches antérieures ont démontré une corrélation entre les scores cliniques et la progression des biomarqueurs d'imagerie (Krismer, 2024), où des mesures structurelles et de diffusion spécifiquement sélectionnées peuvent être utilisées pour suivre la progression de la maladie dans les essais cliniques sur la MSA (Raghavan, 2024).
Quels biomarqueurs IRM peuvent être utilisés pour évaluer l'atrophie cérébrale dans la MSA?
Les biomarqueurs IRM sont de plus en plus utilisés dans les essais cliniques pour évaluer l'atrophie cérébrale dans la MSA. La plupart des biomarqueurs connus peuvent être générés à partir d'examens IRM anatomiques pondérés en T1 ou T2. Les IRM 3D pondérées en T1 (3D T1W) sont principalement utilisées dans les essais cliniques pour évaluer l'atrophie. L'atrophie cérébrale est fréquente dans les maladies neurologiques, y compris la MSA, et se caractérise par une perte de neurones et de connexions entre les neurones (Andravizou, 2019). Le diagnostic des maladies neurologiques peut être facilité par l'identification des régions présentant une atrophie significative, et les critères diagnostiques actuels de la MSA exigent des preuves d'imagerie pour établir la MSA clinique (Liu, 2024). Outre l'utilisation diagnostique, la quantification longitudinale de l'atrophie dans ces régions vulnérables peut être utilisée pour suivre la progression de la maladie et l'évaluation de l'efficacité du traitement.
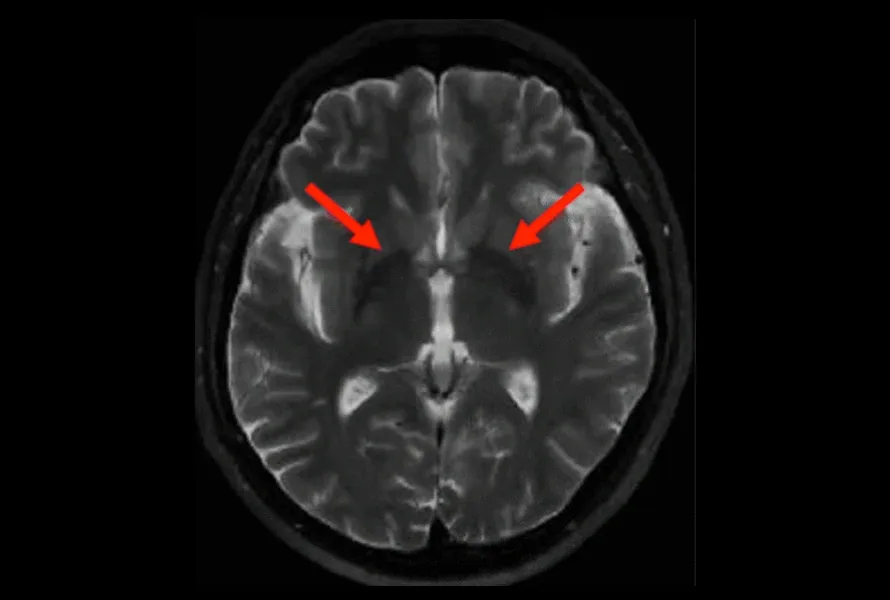
Image IRM pondérée en T2 montrant une atrophie du putamen chez un sujet MSA (flèches rouges).
Signes radiologiques
Atrophie et hypertrophie du putamen
L'atrophie disproportionnée du putamen est une caractéristique déterminante de la MSA-C et de la MSA-P, et peut aider à différencier la MSA d'autres affections neurologiques. En outre, la discontinuité ou la rupture irrégulière de la bordure putaminale hypointense (HPR) est de plus en plus utilisée comme indicateur de MSA-P (Kim, 2017). Auparavant, seule la présence d'une HPR était utilisée comme marqueur d'imagerie, mais avec l'utilisation de plus en plus courante des scanners 3T, il a été prouvé qu'elle n'était pas spécifique et qu'il s'agissait d'un résultat normal sur les images pondérées en T2. Au contraire, sa perturbation a été identifiée comme un résultat important dans la MSA. En outre, il a été recommandé d'ajouter une acquisition FLAIR pour confirmer la discontinuité ou la perturbation irrégulière de la HPR (Lee, 2005).
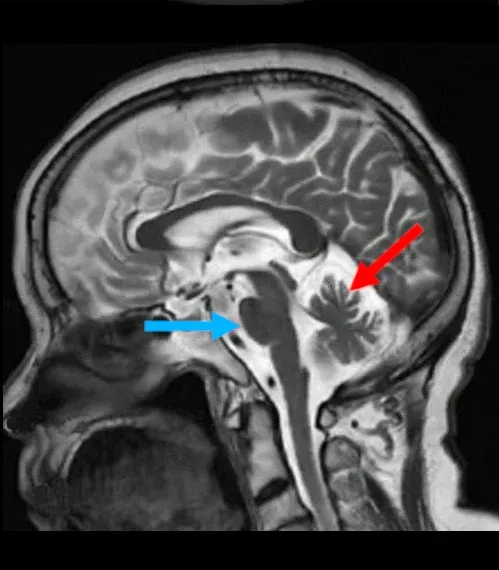
Images IRM pondérées en T2 montrant une atrophie pontine (flèche bleue) et une atrophie cérébelleuse chez un sujet atteint de MSA (flèche rouge).
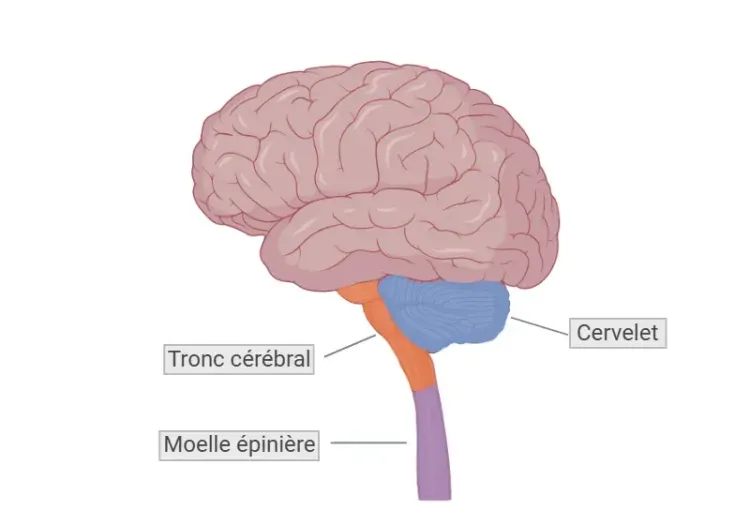
Atrophie du cervelet, du pons et du tronc cérébral
Bien qu'il puisse être difficile de différencier la MSA-C de la MSA-P en raison du chevauchement important des régions touchées, la présence d'une atrophie dans le cervelet et le pons est très fréquente dans la MSA-C et devient plus importante à mesure que la maladie progresse, ce qui facilite l'identification des sous-types (Gilman, 2008).
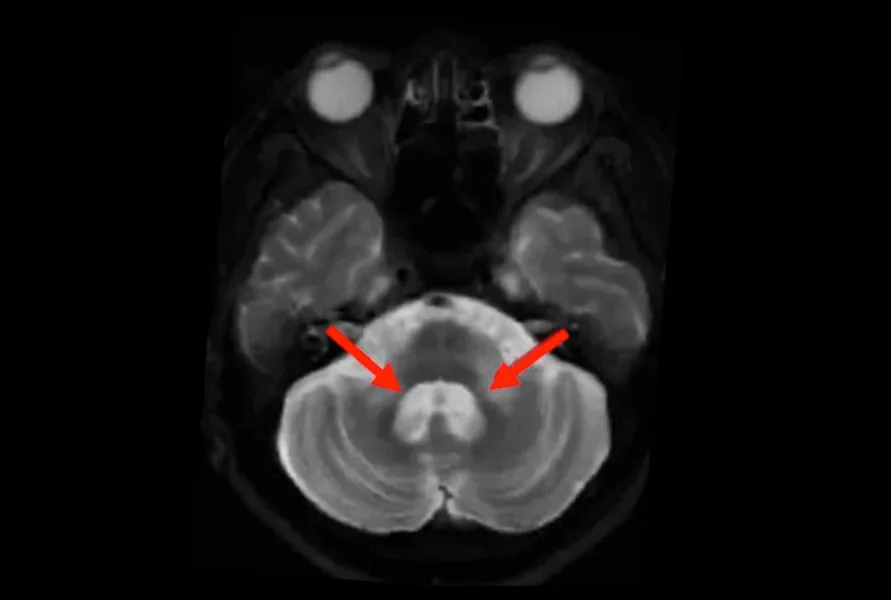
Images IRM pondérées en T2 montrant un signal hyperintense et une atrophie dans la MCP d'un sujet atteint de MSA (flèches rouges).
Hyperintensité et atrophie du pédoncule cérébelleux moyen (MCP)
Un signal hyperintense pondéré en T2 dans les voies pontocérébelleuses (pons, pédoncule cérébelleux moyen et cervelet) reflète la dégénérescence des voies de la substance blanche qui relient le cervelet au tronc cérébral. Ce signe particulier peut aider à différencier la MSA d'autres maladies (Jiang, 2024).
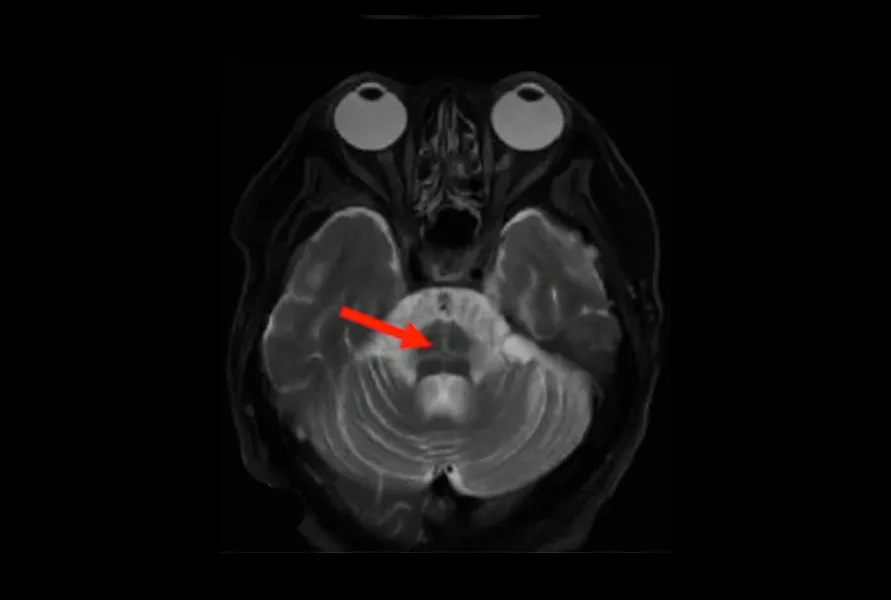
Images IRM pondérées en T2 montrant le « hot cross bun sign » dans le pons d'un sujet atteint de MSA (flèche rouge).
« Hot Cross Bun Sign »
Un autre biomarqueur IRM courant dans la MSA-C, connu sous le nom de « hot cross bun sign », se caractérise par une hyperintensité cruciforme secondaire à l'atrophie des fibres pontines transversales (Vijayan, 2008). Il résulte de la dégénérescence des fibres pontines et pontocérébelleuses avec la préservation du tractus corticospinal et apparaît comme une croix hyperintense dans le pons sur les images pondérées en T2 (Chelban, 2019).
Images adaptées de Liu, 2024, sous la Creative Commons Attribution License).
Mesures quantitatives de l'atrophie régionale
Les mesures volumétriques quantitatives obtenues à partir de l'IRM anatomique constituent un puissant biomarqueur d'imagerie de l'atrophie régionale et sont essentielles pour le diagnostic et le suivi de la progression de la maladie. L'utilisation de biomarqueurs quantitatifs dans les essais cliniques, en particulier par le suivi de l'évolution longitudinale des mesures volumétriques, permet d'obtenir des informations détaillées sur la progression biologique et les effets thérapeutiques.
Compte tenu des coûts élevés et de la complexité des essais cliniques, il est essentiel de pouvoir détecter les changements dans les plus brefs délais. Il est essentiel de se concentrer sur les structures cérébrales les plus touchées par la maladie pour détecter rapidement les effets du traitement. Dans le contexte de la MSA, l'atrophie du putamen, du pons et du pédoncule cérébelleux moyen peut être utilisée pour identifier cette population clinique et suivre sa progression. En outre, une atrophie importante du cervelet est fortement associée à la MSA-C, ce qui peut aider à différencier les sous-types de MSA (Gilman, 2008).
Afin de détecter des changements dans les populations d'essais cliniques, l'exactitude (dans quelle mesure la valeur mesurée est proche de la valeur réelle) et la précision (dans quelle mesure une mesure est reproductible) avec lesquelles les biomarqueurs de la maladie peuvent être quantifiés, jouent un rôle important dans la conception de l'essai clinique. Il est évident que les processus et systèmes souhaitables produisent des résultats à la fois exacts et précis. Il existe cependant de nombreuses sources de variabilité des mesures dans les biomarqueurs de neuro-imagerie qui peuvent être difficiles à quantifier et à contrôler. Outre la variabilité biologique (c'est-à-dire les différences entre les sujets), la variabilité méthodologique inhérente à l'acquisition et à l'analyse des images médicales joue également un rôle important. En utilisant la plateforme de traitement d'images de Biospective, nous avons évalué notre fiabilité test-retest sur une cohorte de données issues de la Parkinson's Progression Markers Initiative (PPMI ; ppmi-info.org), et comparé les résultats avec les analyses dérivées de FreeSurfer (une plateforme d'analyse de neuroimagerie puissante, gratuite et open-source) compte tenu de son utilisation répandue par la communauté de la recherche académique. Les données illustrées dans les tableaux et graphiques ci-dessous montrent clairement la variabilité méthodologique réduite de la plateforme Biospective, qui a été spécialement conçue et continuellement affinée pour la neuro-imagerie dans les essais cliniques. Cette variabilité réduite a un effet direct sur la capacité à détecter des changements dans les données d'imagerie et sur la taille de l'échantillon nécessaire à l'étude.
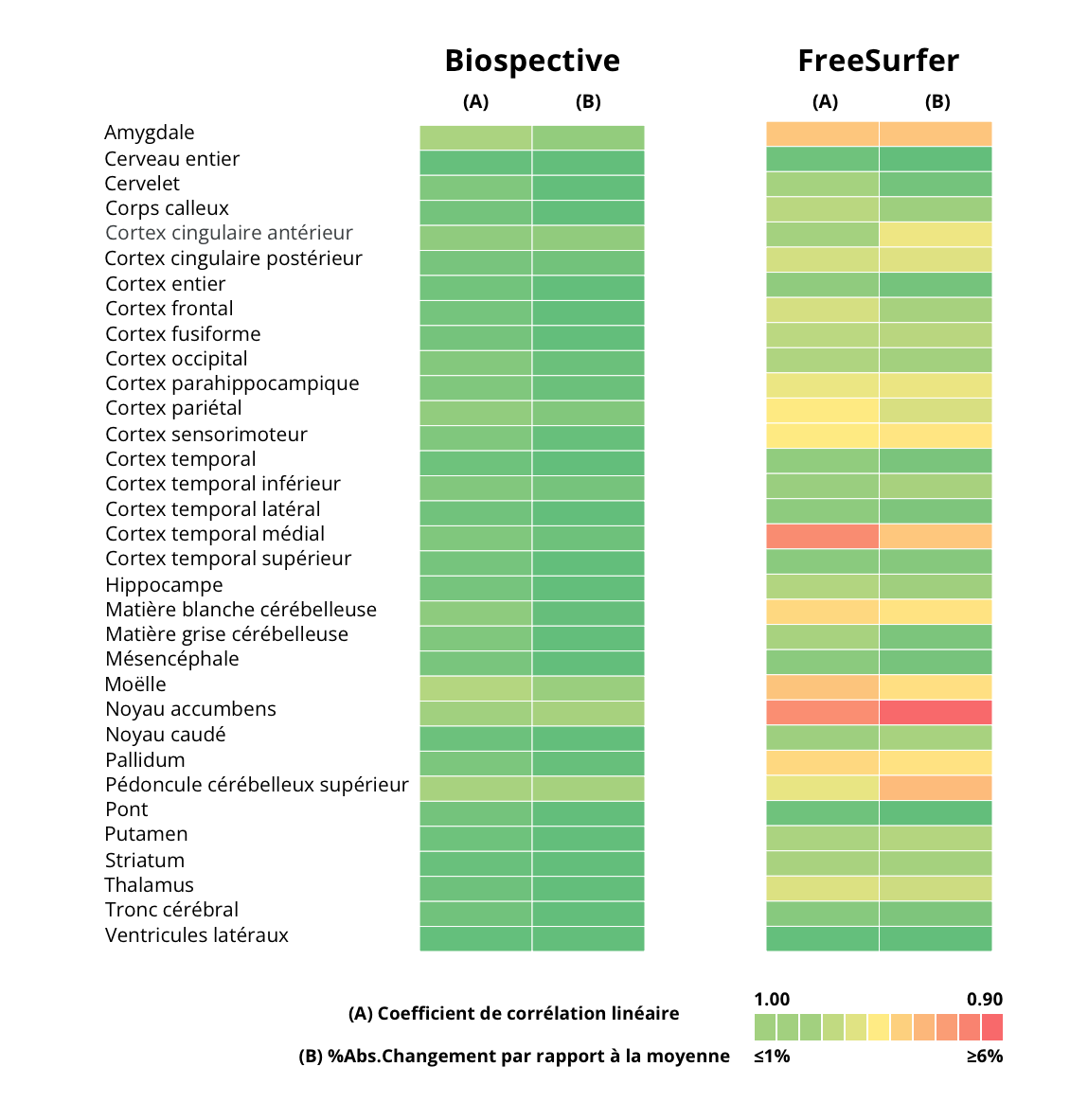
La corrélation test-retest a été réalisée sur les données du PPMI. Deux acquisitions ont été réalisées au cours de la même session de balayage, et seules les paires indépendantes de balayages qui ont passé l'examen du contrôle de la qualité de l'image (CQ) et dont les paramètres d'acquisition correspondaient ont été utilisées pour l'analyse (N=243). Nous avons utilisé FreeSurfer pour la comparaison. Le tableau indique les coefficients de corrélation linéaire (CC linéaire) de Biospective et de FreeSurfer entre les tests, ainsi que le % de changement abs par rapport à la moyenne pour un ensemble de régions corticales et sous-corticales. Notez que le vert indique un coefficient de corrélation plus élevé et un % de changement abs. par rapport à la moyenne plus faible.
Les diagrammes de dispersion des corrélations test-retest entre les analyses Biospective (bleu) et FreeSurfer (rouge) illustrent graphiquement les corrélations entre chaque scan individuel du sujet sur l'axe des x et le scan répété sur l'axe des y. Notez la réduction de la dispersion dans toutes les régions évaluées dans les diagrammes test-retest de Biospective.
L'imagerie pondérée en fonction de la diffusion (DWI) est-elle utile en tant que biomarqueur dans les études sur la MSA?
L'imagerie pondérée par la diffusion repose sur la mesure du mouvement brownien aléatoire (mouvement aléatoire erratique de particules microscopiques dans un fluide) des molécules d'eau à l'intérieur d'un voxel de tissu. La DWI repose sur le mouvement aléatoire des protons de l'eau, qui diffusent librement dans l'espace extracellulaire, mais sont limités dans l'espace intracellulaire (Kawahara, 2021). Cette modalité d'IRM joue un rôle dans l'identification de nombreux résultats cliniques, y compris, mais sans s'y limiter, les accidents vasculaires cérébraux, les lésions corticales, l'encéphalite herpétique et la démyélinisation.
Pour le diagnostic de la MSA, étant donné que le mouvement aléatoire des molécules d'eau est accru dans la neurodégénérescence et l'ischémie (Chelban, 2019), la DWI fournit des biomarqueurs utiles. La DWI identifie les dommages microstructuraux dans le cerveau, que l'IRM conventionnelle ne peut pas détecter, en utilisant la quantification du mouvement des molécules d'eau (Kim, 2017).
Grâce à la DWI, l'augmentation de la diffusivité dans le putamen et le pédoncule cérébelleux moyen est un indicateur fort de l'AMS. Notamment, les cartes du coefficient de diffusion apparent (ADC) montrent une diffusivité plus élevée dans le pons, le cervelet et le putamen par rapport aux sujets atteints de la MP ou aux témoins en bonne santé, tandis que l'anisotropie fractionnelle (FA) est plus faible dans ces mêmes zones (Dąbrowska, 2015). Les mesures supplémentaires couramment utilisées sont la diffusivité axiale (AD), la diffusivité radiale (RD) et la diffusivité moyenne (MD), qui permettent d'évaluer les modifications de la substance blanche dans la MSA mieux que les séquences d'IRM standard. Par exemple, les fibres pontocérébelleuses transversales, les voies corticospinales, le pons et le cervelet présentent une MD accrue (Loh, 2011).
Dans les essais cliniques, les altérations de la DWI peuvent être corrélées à la durée ou à la gravité de la maladie chez les patients. Le diagnostic repose de plus en plus sur les mesures DWI (Meyyappan, 2024). Cependant, des évaluations longitudinales utilisant des approches IRM multimodales combinant des mesures volumétriques, DWI, et des séquences sensibles au fer peuvent encore améliorer le diagnostic et le suivi de la progression de la maladie.
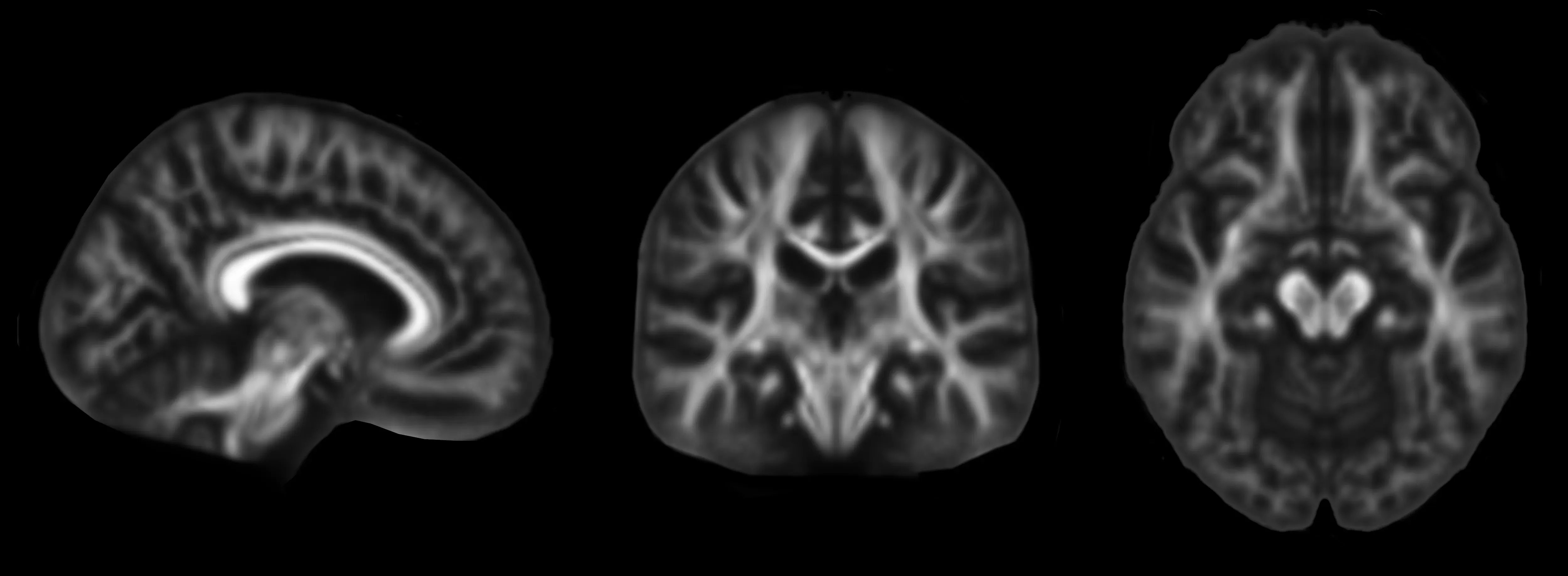
Vues orthogonales des cartes d'anisotropie fractionnelle (FA) dérivées des données DTI.
Notre équipe se fera un plaisir de répondre à vos questions sur l'IRM dans les essais cliniques sur l'atrophie du système multiple ou de vous fournir des informations spécifiques sur nos autres services d'imagerie.
Découvrez nos services d'imagerie
Contenu connexe
Informations actualisées sur les meilleures pratiques liées à l'utilisation de la neuroimagerie dans les essais cliniques sur les maladies neurologiques.
Essais cliniques et biomarqueurs d'imagerie pour l'ataxie spinocérébelleuse
Vue d'ensemble des biomarqueurs d'imagerie IRM structurelle, DTI et MRS pour surveiller la progression de la maladie dans les essais cliniques sur l'ataxie spinocérébelleuse.
Biomarqueurs TEP dans les essais cliniques sur la maladie de Huntington
Un aperçu de l'utilisation des biomarqueurs d'imagerie TEP pour les essais cliniques de la maladie de Huntington (MH).
Biomarqueurs IRM dans les essais cliniques de la maladie de Huntington
Un aperçu de l'utilisation des biomarqueurs d'imagerie IRM structurelle et de diffusion pour les essais cliniques de la maladie de Huntington (MH).
La neuroimagerie dans la démence frontotemporale et les essais cliniques
L'utilité des biomarqueurs d'imagerie IRM et TEP dans notre compréhension des variantes de la démence frontotemporale (DFT) et leur utilisation comme critères d'évaluation dans les essais cliniques sur la DFT.
Essais cliniques sur les lésions renforcées par le gadolinium en IRM dans la SP
Comment les lésions rehaussées par le gadolinium (Gd) sont utilisées pour suivre la progression de la maladie et la réponse à l'intervention thérapeutique dans les essais cliniques sur la sclérose en plaques (SP).
Biomarqueurs d'imagerie pour la paralysie supranucléaire progressive (PSP)
Aperçu des différentes méthodes d'imagerie cérébrale (IRM, PET, SPECT) disponibles pour évaluer l'efficacité des traitements de fond dans les essais cliniques sur la PSP.
Biomarqueurs d'imagerie pour distinguer la CBD des autres tauopathies
Vue d'ensemble des biomarqueurs d'imagerie cérébrale permettant d'identifier les sujets atteints de dégénérescence corticobasale (CBD) et de leur utilisation dans le cadre d'essais cliniques de traitements modificateurs de la maladie.
Évolution longitudinale de la TEP Tau dans la MCI et la maladie d'Alzheimer
Vue d'ensemble de l'histoire naturelle de l'évolution de l'absorption et de la fixation du traceur de la TEP Tau dans les troubles cognitifs légers (MCI) et la maladie d'Alzheimer (AD).