Cette ressource décrit:
- Quels sont les biomarqueurs TEP les plus efficaces pour suivre la progression de la MH?
- Quelle est la corrélation entre les biomarqueurs d'imagerie TEP et les mesures traditionnelles des résultats cliniques de la MH?
- Quelles sont les orientations futures de l'imagerie TEP dans les essais cliniques sur la MH?
Quels sont les biomarqueurs TEP les plus efficaces pour suivre la progression de la MH?
La maladie de Huntington
La maladie de Huntington (MH) est une maladie neurodégénérative rare et progressive qui se transmet selon le mode autosomique dominant. Les symptômes apparaissent généralement entre 35 et 40 ans, mais dans de rares cas, la maladie de Huntington juvénile (MHJ) peut se manifester avant l'âge de 20 ans (Klöppel, 2009). La maladie se caractérise par un déclin progressif des fonctions motrices, des capacités cognitives et de la santé neuropsychiatrique. La cause sous-jacente de la MH est une mutation du gène HTT, où une expansion des répétitions CAG entraîne la production d'une protéine de huntingtine mutante toxique (mHTT). Lorsque le nombre de répétitions CAG dépasse 39, la maladie se manifeste, un nombre élevé de répétitions étant corrélé à une apparition plus précoce et à une progression plus rapide de la maladie (Reiner, 2011; Wijeratne, 2021).
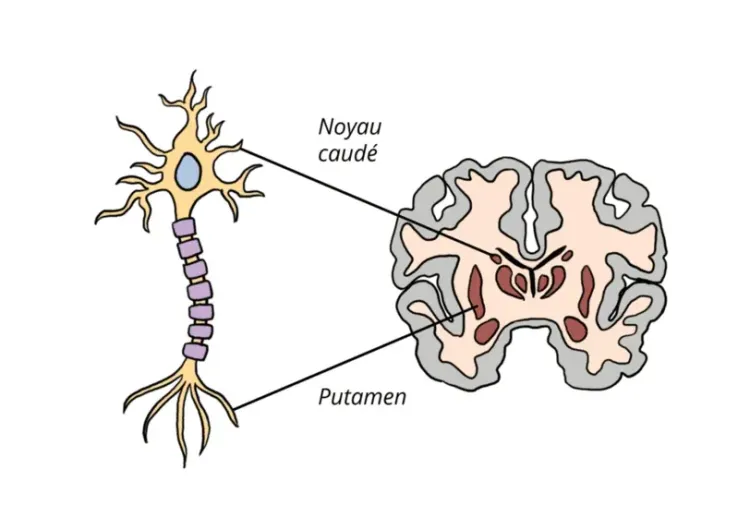
L'une des principales caractéristiques pathologiques de la MH est la dégénérescence des neurones à épines moyennes (MSN) dans le striatum, accompagnée de changements structurels tels que l'atrophie striatale. La neuro-imagerie, en particulier l'imagerie par résonance magnétique (IRM) et la tomographie par émission de positons (TEP), permet de détecter des changements cérébraux précoces, souvent avant l'apparition des symptômes moteurs, ce qui fournit des informations cruciales sur la progression de la maladie et des pistes potentielles pour une intervention précoce (Klöppel, 2009; Hobbs, 2024).
Bien qu'il n'existe actuellement aucun traitement modificateur de la maladie, les recherches en cours se concentrent sur le ciblage des agrégats de mHTT, qui jouent un rôle central dans la pathologie de la maladie. L'imagerie TEP permet de suivre la progression de la maladie en visualisant divers changements moléculaires et métaboliques dans le cerveau. Il s'agit notamment des altérations du métabolisme du glucose, de l'activité dopaminergique, des niveaux de phosphodiestérase et de la neuroinflammation (Cybulska, 2020). En outre, le développement de nouveaux radioligands TEP visant à quantifier et à suivre les agrégats de mHTT est en cours, avec le potentiel de devenir des outils précieux pour évaluer l'efficacité de nouvelles approches thérapeutiques (Fazio, 2018; Cybulska, 2020; Dickmann, 2024).
Métabolisme cérébral du glucose
L'un des premiers biomarqueurs de la MH est l'hypométabolisme striatal, qui peut être détecté par l'imagerie TEP au [18F]fluorodéoxyglucose (FDG). Ce déclin métabolique se produit souvent avant l'apparition des symptômes cliniques. Des études longitudinales ont montré que le métabolisme du glucose diminue progressivement dans les régions sous-corticales et corticales du cerveau, notamment le striatum, le thalamus, l'insula, le gyrus cingulaire postérieur, le cortex préfrontal et le cortex occipital (Fazio, 2018). En outre, les réductions du métabolisme cortical du glucose sont liées à l'aggravation des déficits cognitifs (Fazio, 2018).
Dans la MHJ, la captation du FDG est plus faible dans le striatum et le cortex entorhinal que dans la MH. À l'inverse, les personnes atteintes de la MH à l'âge adulte présentent des réductions plus importantes dans les zones corticales, telles que le gyrus pariétal inférieur gauche et le gyrus cingulaire gauche (Caligiuri, 2024). Les études longitudinales révèlent également des schémas différents de déclin métabolique, la MH présentant une réduction plus cohérente de la captation corticale du FDG, tandis que la MHJ progressive présente une plus grande variabilité (Caligiuri, 2024). Il est intéressant de noter que les études TEP ont identifié un hypermétabolisme thalamique précoce chez les porteurs du gène de la MH avant la manifestation, qui tend à diminuer une fois que les symptômes cliniques se manifestent (Feigin, 2007). Cet hypermétabolisme thalamique précoce peut refléter des mécanismes compensatoires, bien que son rôle précis reste incertain (Feigin, 2007; Hellem, 2021).
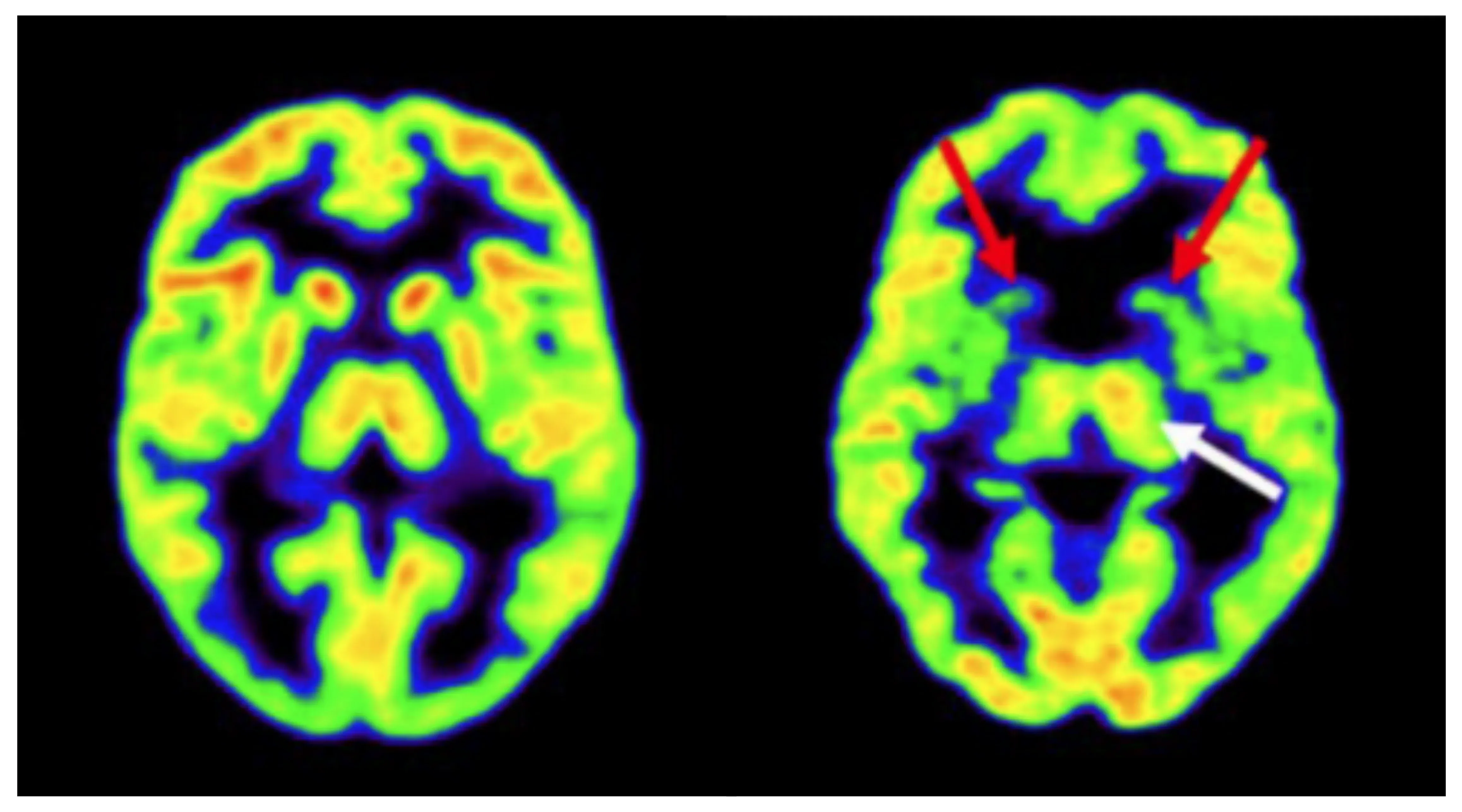
TEP-FDG d'un témoin sain (à gauche) et d'un porteur de l'expansion du gène HD avant la manifestation (à droite). Le porteur de l'expansion du gène HD présente un métabolisme striatal bilatéral réduit (flèches rouges) et une augmentation compensatoire potentielle du métabolisme dans le thalamus gauche (flèche blanche). Figure adaptée de Hellem et al. (Hellem, 2021) sous la licence Creative Commons Attribution License.
Marqueurs d'imagerie dopaminergique
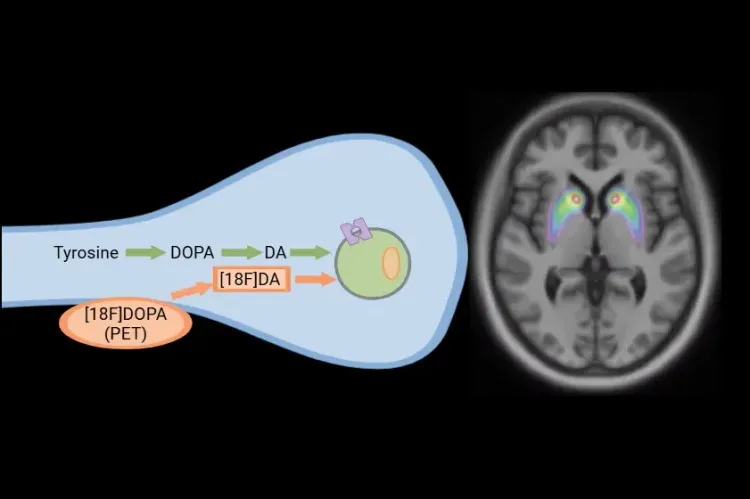
La dégénérescence des MSN dans le striatum est une caractéristique déterminante de la MH, qui entraîne un dysfonctionnement de l'activité des récepteurs de la dopamine. L'imagerie TEP utilisant des traceurs ciblant les récepteurs dopaminergiques D1 et D2/3 permet de mieux comprendre la progression de la maladie. Par exemple, des études utilisant le traceur [11C]SCH-23390 montrent une réduction significative de la densité des récepteurs D1 dans le putamen des personnes atteintes de la MH manifeste, avec une diminution d'environ 50 % par rapport aux témoins sains (Cybulska, 2020). Des études longitudinales ont démontré que la perte de récepteurs D1 se produit plus graduellement dans la MH prémanifeste, avec un taux de déclin annuel plus lent de 2 %, comparé à un taux plus rapide de 5 % par an chez les personnes atteintes de MH manifeste (Cybulska, 2020).
De même, l'imagerie TEP avec le [11C]raclopride, un traceur TEP pour la quantification des récepteurs D2/3, a montré une perte significative des récepteurs D2 dans le striatum, qui varie selon le stade de la maladie, la MH prémanifestante présentant une perte de 10 à 50 %, contre 40 à 60 % dans la MH manifeste (Fazio, 2018). En outre, dans la MH manifeste, la réduction de la liaison D2/3 dans le cortex est en corrélation avec de moins bonnes performances aux tests neuropsychologiques, en particulier ceux qui évaluent la fluidité verbale et la mémoire (Cybulska, 2020).
Les études d'imagerie TEP utilisant des marqueurs présynaptiques, tels que la [11C]dihydrotétrabenazine (DTBZ), révèlent une réduction de la liaison du transporteur vésiculaire de monoamine 2 (VMAT2) dans le striatum des patients atteints d'une maladie de Huntington manifeste. En outre, les examens TEP [11C]β-CIT ont démontré une réduction de 50 % de la liaison du transporteur de dopamine (DAT) dans le striatum, ce qui confirme le rôle du dysfonctionnement dopaminergique dans la pathologie de la MH (Fazio, 2018).
Imagerie de la phosphodiestérase 10A (PDE10A)
La PDE10A est une enzyme fortement exprimée dans les MSN qui peut être surveillée par imagerie TEP avec des ligands tels que [18F]JNJ42249152, [18F]MNI-659 et [11C]IMA-107 (Fazio, 2018). Dans la MH manifeste, l'imagerie TEP révèle une réduction significative de la liaison striatale, qui est en corrélation avec la gravité de la maladie (Cybulska, 2020). Des études longitudinales ont montré que cette réduction est plus prononcée dans le putamen, le noyau caudé et le globus pallidus par rapport aux témoins sains, avec des taux de déclin annuels plus importants (Cybulska, 2020).
Il est intéressant de noter que, dans le cas de la MH non déclarée, une augmentation de la liaison a été observée dans les noyaux thalamiques moteurs, ce qui suggère une réponse compensatoire qui s'atténue à mesure que les symptômes se manifestent (Cybulska, 2020). Ces altérations précoces de la PDE10A peuvent être détectées jusqu'à 25 ans avant l'apparition des symptômes cliniques et peuvent servir de biomarqueur prédictif de l'apparition de la maladie, offrant ainsi une cible potentielle pour l'intervention (Niccolini, 2015).
Marqueurs de la neuroinflammation
La neuroinflammation est une autre caractéristique de la MH, l'activation microgliale étant un indicateur clé. L'imagerie TEP utilisant des traceurs qui ciblent la protéine translocatrice 18-kDa (TSPO), comme le [11C]PK11195, a montré une liaison accrue du radioligand à la fois dans la MH pré-manifeste et manifeste, ce qui suggère que l'activation microgliale à un stade précoce est un biomarqueur potentiel de la maladie (Cybulska, 2020). Une augmentation de la liaison a été observée dans plusieurs zones du cerveau, notamment le striatum, le cortex, le globus pallidus et l'insula, régions impliquées dans les fonctions motrices, cognitives et psychiatriques (Cybulska, 2020). Ce marqueur neuroinflammatoire pourrait s'avérer utile pour la stratification des patients dans les essais cliniques visant à modifier les thérapies de la maladie, en aidant potentiellement à l'identification précoce des individus à risque de conversion symptomatique (Hobbs, 2024).
Globalement, la MH est une maladie neurodégénérative complexe, et les progrès de la neuro-imagerie ont considérablement amélioré notre compréhension de sa progression précoce. L'imagerie TEP a révélé des biomarqueurs clés liés au métabolisme du glucose, à l'activité dopaminergique, à l'expression des phosphodiestérases et à la neuroinflammation. Ces informations permettent non seulement de suivre l'évolution de la maladie, mais offrent également des cibles potentielles pour des interventions thérapeutiques.
Quelle est la corrélation entre les biomarqueurs d'imagerie TEP et les mesures traditionnelles des résultats cliniques de la MH?
L'imagerie TEP constitue un outil puissant pour suivre la progression précoce de la maladie dans la MH, en étroite corrélation avec les mesures des résultats cliniques. Par exemple, l'imagerie TEP au FDG dans la MH pré-manifestante montre une forte corrélation négative entre le métabolisme striatal et le score CAG et produit de l'âge (CAP). Cette observation suggère qu'à mesure que les individus approchent de l'apparition des symptômes moteurs, l'activité métabolique dans le striatum diminue (Hellem, 2021). Il est intéressant de noter que le métabolisme du striatum explique davantage la variation des scores CAP que les mesures de volume par IRM, ce qui souligne la sensibilité de la TEP dans le suivi de la progression de la maladie à des stades plus précoces (Hellem, 2021).
Outre les changements striataux, il a été démontré que l'hypométabolisme cortical progressif dans la MH prémanifestée est en corrélation avec la progression des déficits cognitifs (Fazio, 2018). L'hypométabolisme dans le caudé et le putamen des porteurs de la MH prémanifestante est lié à un risque plus élevé de conversion symptomatique (Hobbs, 2024). Des données transversales suggèrent également une corrélation entre l'hypométabolisme des ganglions de la base et une vitesse psychomotrice plus lente chez les porteurs de la MH prémanifeste (Hobbs, 2024).Dans la MH manifeste, l'hypométabolisme striatal et cortical est corrélé à la capacité fonctionnelle, à la fonction motrice, à l'apprentissage verbal, à la mémoire et à la déficience cognitive globale (Hobbs, 2024). En outre, l'hypométabolisme cortical aux stades pré-manifeste et manifeste est associé à des difficultés dans la résolution de problèmes arithmétiques, tandis que les changements dans les réseaux métaboliques corticaux et limbiques au début de la MH manifeste sont en corrélation avec l'apathie.
Dans la MHJ, des changements annuels plus importants dans le métabolisme du glucose ont été associés à une aggravation de la dystonie, du parkinsonisme et à une réduction de l'autonomie (Caligiuri, 2024). Des études d'imagerie TEP ont également montré que la diminution de la liaison des récepteurs D2 striataux dans la MH pré-manifeste est corrélée à un dysfonctionnement exécutif et à une moins bonne fluidité verbale, tandis que la perte de la liaison de la PDE10A dans les stades pré-manifeste et manifeste est associée à une déficience motrice (Hobbs, 2024).
Quelles sont les orientations futures de l'imagerie TEP dans les essais cliniques sur la MH?
L'une des orientations les plus prometteuses de la recherche sur la MH est le développement de radioligands TEP qui se lient spécifiquement aux agrégats de mHTT. Ces radioligands pourraient jouer un rôle essentiel dans les essais cliniques visant à réduire les taux de mHTT, en permettant aux chercheurs de visualiser et de quantifier l'engagement de la cible cérébrale et en donnant ainsi un aperçu de la distribution régionale (Lieberman, 2022; Hobbs, 2024). Cependant, le défi réside dans l'abondance relativement faible des agrégats de mHTT par rapport aux protéines mal repliées dans d'autres maladies neurodégénératives, telles que la maladie d'Alzheimer (AD) et la maladie de Parkinson (PD) (Dickmann, 2024). Pour résoudre ce problème, il faut développer des ligands à haute affinité qui sont très sélectifs pour le mHTT par rapport à d'autres agrégats de protéines comme le TDP-43, l'alpha-synucléine, la tau et l'amyloïde-bêta (Dickmann, 2024).
Plusieurs ligands TEP prometteurs ont été testés pour leur capacité à cibler le mHTT, notamment le [11C]CHDI-180R, le [11C]CHDI-626, le [18F]1 et le [18F]CHDI-650. Malgré leur potentiel, beaucoup de ces ligands ont montré une sélectivité et une affinité limitées pour le mHTT, et certains ont été abandonnés en raison d'une efficacité insuffisante (Dickmann, 2024). Pour résoudre ce problème, la recherche continue de se concentrer sur la conception et l'évaluation de nouveaux radioligands TEP capables de cibler de manière fiable le mHTT in vivo (NCT06634628). Le développement réussi de ces radioligands fournirait une méthode non invasive de détection et de surveillance des agrégats de mHTT, une avancée essentielle pour les essais cliniques et le diagnostic précoce de la MH (Kaur, 2021).
En outre, ces radioligands pourraient fournir des informations précieuses sur la progression de la maladie, permettant une stratification plus précise des patients dans les essais cliniques. Ils pourraient également jouer un rôle essentiel dans l'évaluation des réponses aux traitements de fond ciblant le mHTT, améliorant ainsi l'efficacité des traitements (Kaur, 2021).
Dans la MH, l'accumulation d'agrégats de protéines mHTT, en particulier dans le striatum, entraîne une neurodégénérescence et est associée à des déficiences motrices, cognitives et neuropsychiatriques. Les radioligands TEP ayant une affinité et une sélectivité élevées pour le mHTT sont encore en cours de développement, mais ils sont prometteurs pour la quantification objective de la charge de mHTT dans le cerveau. Ces outils pourraient constituer un marqueur crucial pour le suivi de la progression de la maladie et l'évaluation de nouvelles thérapies ciblant le mHTT dans le cadre d'essais cliniques, ce qui permettrait de faire progresser les stratégies diagnostiques et thérapeutiques de la maladie de Huntington.
Cliquez pour copier le lien
Notre équipe se fera un plaisir de répondre à vos questions sur les biomarqueurs TEP dans les essais cliniques de la maladie de Huntington ou de vous fournir des informations spécifiques sur nos autres services d'imagerie.
Découvrez nos services d'imagerie
Contenu connexe
Informations actualisées sur les meilleures pratiques liées à l'utilisation de la neuroimagerie dans les essais cliniques sur les maladies neurologiques.
[18F]DOPA PET dans les essais cliniques sur la maladie de Parkinson
Comment la [18F]DOPA PET est utilisée pour surveiller la progression de la maladie et la réponse à l'intervention thérapeutique dans les essais cliniques sur la maladie de Parkinson et les troubles du mouvement.
Essais cliniques et biomarqueurs d'imagerie pour l'ataxie spinocérébelleuse
Vue d'ensemble des biomarqueurs d'imagerie IRM structurelle, DTI et MRS pour surveiller la progression de la maladie dans les essais cliniques sur l'ataxie spinocérébelleuse.
Biomarqueurs IRM dans les essais cliniques de la maladie de Huntington
Un aperçu de l'utilisation des biomarqueurs d'imagerie IRM structurelle et de diffusion pour les essais cliniques de la maladie de Huntington (MH).
Biomarqueurs de neuro-imagerie pour la sclérose tubéreuse de Bourneville (STB)
Aperçu des biomarqueurs d'IRM et d'imagerie pondérée en diffusion pour évaluer l'efficacité des traitements neurologiques dans les essais cliniques de la STB.
Modélisation du mauvais repliement des protéines dans les maladies neurologiques
Modélisation informatique des mécanismes de mauvais repliement des protéines dans la neurodégénérescence et application à la découverte et au développement de traitements modificateurs de la maladie.
Biomarqueurs d'imagerie pour les essais cliniques sur l'ataxie de Friedreich
Un aperçu de l'utilisation des biomarqueurs d'imagerie IRM et DTI pour l'ataxie de Friedreich (FRDA) dans les études de recherche et les essais cliniques multicentriques.
L'IRM dans les essais cliniques sur l'atrophie du système multiple (MSA)
Cette ressource donne un aperçu de l'utilité de l'IRM volumétrique et de l'imagerie pondérée en diffusion (DWI) en tant que biomarqueurs dans les études de recherche sur la MSA.