Cette ressource décrit:
Qu'est-ce que la [18F]DOPA?
Le [18F]DOPA (fluorodopa, également appelé 18F-DOPA, [18F]F-DOPA, [18F]FDOPA, ou, plus formellement, 6-[18F]fluoro-L-DOPA, 6-[18F]FDOPA, ou 6-[18F]fluoro-L-3,4-dihydroxyphénylalanine) est un traceur radiopharmaceutique utilisé en imagerie par tomographie par émission de positons (PET) (Booij, 1999; Deng, 2002). Il s'agit d'une forme marquée de la L-DOPA, un précurseur de la dopamine (DA), un neurotransmetteur clé impliqué dans le mouvement, la motivation et la récompense.
La principale application du [18F]DOPA est d'évaluer la fonction des systèmes dopaminergiques dans le cerveau. Il y a plusieurs décennies, il a été démontré que l'absorption du traceur PET [18F]DOPA in vivo reflétait les niveaux de cellules dopaminergiques après un examen post-mortem du cerveau (Snow, 1993). Depuis lors, des études ont montré de manière constante que la diminution de l'absorption de [18F]DOPA est corrélée à la perte de neurones dopaminergiques dans la maladie de Parkinson (MP), en particulier dans le putamen (Morrish, 1996, 1998; Hilker, 2005; Maetzler, 2009; Nandhagopal, 2009; Arya, 2024). En tant que tel, il est largement considéré comme un outil d'imagerie précieux pour l'étude des troubles du mouvement, tels que la MP. Outre son application à la MP et aux troubles du mouvement associés, le [18F]DOPA est également utilisé dans les études sur la maladie de Huntington (Michler, 2019), ainsi que dans les applications oncologiques pour visualiser et évaluer les tumeurs (par exemple, le gliome) (Breen, 2022). En outre, l'utilisation de la PET [18F]DOPA est également à l'étude pour d'autres maladies, telles que la fibromyalgie (Ledermann, 2021).
le [18F]DOPA a été officiellement approuvé dans l'UE en 2006 et aux États-Unis en 2019 pour le diagnostic de la MP et la distinction entre le tremblement essentiel et les syndromes parkinsoniens (Chevalme, 2007; Dhawan, 2020; Dhawan, 2022). Cette autorisation a marqué une étape importante, élargissant le champ d'application clinique du [18F]DOPA. Au-delà de son utilisation principale dans l'étude de la fonction dopaminergique, des essais en cours visent à améliorer la qualité de l'image ou à étendre son utilisation à d'autres populations et pathologies (Abele, 2021). En outre, des études sont en cours pour évaluer le potentiel de l'imagerie PET [18F]DOPA dans la prise en charge des troubles psychiatriques, tels que la schizophrénie et les troubles de l'humeur, en raison de sa capacité à cartographier l'activité et le dysfonctionnement dopaminergiques dans le cerveau (Cheng, 2020).
Quels sont les avantages et les inconvénients de la [18F]DOPA par rapport à d'autres traceurs, par exemple le DaTscan?
Mécanisme
Tout d'abord, pour résumer brièvement la neurotransmission dopaminergique : la dopamine est synthétisée par la conversion de la L-tyrosine par la tyrosine hydroxylase (TH) en L-DOPA, suivie de la décarboxylation de la L-DOPA par l'acide aminé aromatique L-décarboxylase (AADC) (Meiser, 2013). Elle est ensuite stockée dans les vésicules synaptiques et libérée dans la fente synaptique pour la transduction du signal via le récepteur D2. La pompe du transporteur de la dopamine (DAT) facilite la recapture de la dopamine de la fente synaptique dans le neurone présynaptique, puis le transporteur vésiculaire de la monoamine (VMAT2) charge à nouveau la dopamine dans les vésicules synaptiques. Différents traceurs d'imagerie moléculaire ciblent (se lient à) différentes molécules le long de la voie de neurotransmission dopaminergique, comme illustré dans la figure.
Terminal nerveux illustrant les différents radiotraceurs utilisés pour étudier le système dopaminergique. La [18F]DOPA est décarboxylée en [18F]DA (dopamine [18F]) et stockée dans les vésicules synaptiques. Le VMAT-2 (transporteur vésiculaire de la monoamine de type 2) est marqué par le [11C]DTBZ ou le [18F]DTBZ, et le transporteur de la dopamine (DAT) est marqué par le [11C]MP (PET) ou le [123I]FP-CIT (DaTscan SPECT). La disponibilité des récepteurs D2/3 de la dopamine peut être marquée par le [11C]RAC (raclopride), qui est sensible aux niveaux synaptiques de dopamine.
[18F]DOPA reflète principalement la synthèse et le stockage de la dopamine, et fournit donc des informations sur la fonction dopaminergique présynaptique (Morrish, 1996; Heiss, 2004); tandis que [123I]FP-CIT (le traceur utilisé pour DaTscan SPECT) se lie au transporteur de la dopamine (DAT) et reflète donc l'intégrité et la densité des terminaisons dopaminergiques présynaptiques, et non la synthèse (Booij, 1999; Seppi, 2006; Kægi, 2010). Le choix de l'un ou l'autre de ces traceurs dans une étude spécifique dépend de plusieurs facteurs, tels que l'hypothèse spécifique et le mécanisme d'action d'un candidat médicament, la spécificité et la sensibilité attendues du traceur aux changements induits par le médicament, ainsi que d'autres considérations relatives à la conception de l'étude (Bidesi, 2021).
Parmi les autres traceurs PET courants ciblant les mêmes processus, on peut citer le 11C-DTBZ ([11C]dihydrotétrabenazine) et le 18F-DTBZ ([18F]DTBZ, communément appelé AV-133 ou florbenazine) qui se lient tous deux au transporteur vésiculaire de la monoamine 2 (VMAT2), responsable du conditionnement des neurotransmetteurs comme la dopamine dans les vésicules présynaptiques (Stoessl, 2012; Marek, 2018); le 11C-RAC ([11C]raclopride) qui se lie principalement aux récepteurs dopaminergiques postsynaptiques, souvent utilisé pour déterminer comment les médicaments occupent les récepteurs D2/3 (Volkow, 1994 ; Boileau, 2007); et le 11C-MP ([11C]méthylphénidate), un inhibiteur de la DAT qui se lie aux sites DAT dans le striatum (Morrish, 1998; Volkow, 2002 ; Nandhagopal, 2009).
Applicabilité pratique
DaTscan SPECT est largement utilisé pour étudier les syndromes parkinsoniens en raison de son coût relativement faible, de son large agrément réglementaire et de son applicabilité clinique générale. La demi-vie relativement longue du traceur [123I], qui est d'environ 13 heures, permet l'expédition vers une vaste zone géographique, ce qui facilite la logistique de l'examen des patients dans les essais cliniques multicentriques. À l'autre extrémité du spectre, les traceurs [11C] utilisés pour le 11C-DTBZ, le 11C-RAC et le 11C-MP ont une demi-vie très courte (~20 minutes), ce qui signifie qu'un cyclotron sur site est nécessaire pour la PET utilisant ces traceurs, un obstacle pratique majeur pour les essais cliniques multicentriques. La demi-vie du fluor-18, utilisé pour la PET [18F]DOPA et [18F]DTBZ, est d'environ 110 minutes, ce qui est encore relativement court par rapport au DaTscan, mais permet une flexibilité considérablement plus grande que le [11C].
L'un des principaux avantages de la PET par rapport à la TDM est la résolution spatiale de l'image. La TDM SPECT a une faible résolution d'image, généralement de ~7-8 mm, alors que les scanners PET peuvent être acquis à des résolutions spatiales de ~4-5 mm ou même plus, ce qui augmente la spécificité anatomique des images acquises (Rahmim, 2008; Khalil, 2011). De plus, le [18F]DOPA a l'avantage de mesurer directement la synthèse de la dopamine par son absorption et sa conversion par l'AADC, ce qui justifie son utilisation dans la détection précoce. Cette propriété en fait un excellent choix pour étudier la MP précoce et évaluer la capacité de synthèse des neurones dopaminergiques. DaTscan SPECT, en revanche, est principalement utilisé pour le diagnostic clinique de la MP, ainsi que pour différencier la MP d'autres troubles du mouvement; [18F]DOPA PET est mieux adapté pour surveiller la progression de la maladie et évaluer l'effet du traitement.
De plus, la [18F]DOPA présente également un avantage logistique considérable par rapport à la DaTscan SPECT, étant donné que le temps de scannage n'est que de 10 à 20 minutes, contre 30 à 45 minutes pour la DaTscan ; en outre, le temps post-injection (temps entre l'injection du traceur et la séance de scan) est considérablement plus court pour la PET [18F]DOPA (60-90 minutes contre 3-6 heures). En particulier pour une population de patients souffrant de troubles du mouvement, la réduction du temps de préparation et de scan peut être d'une importance vitale pour la qualité des données d'imagerie.
Le tableau suivant résume les différents aspects de ces traceurs:
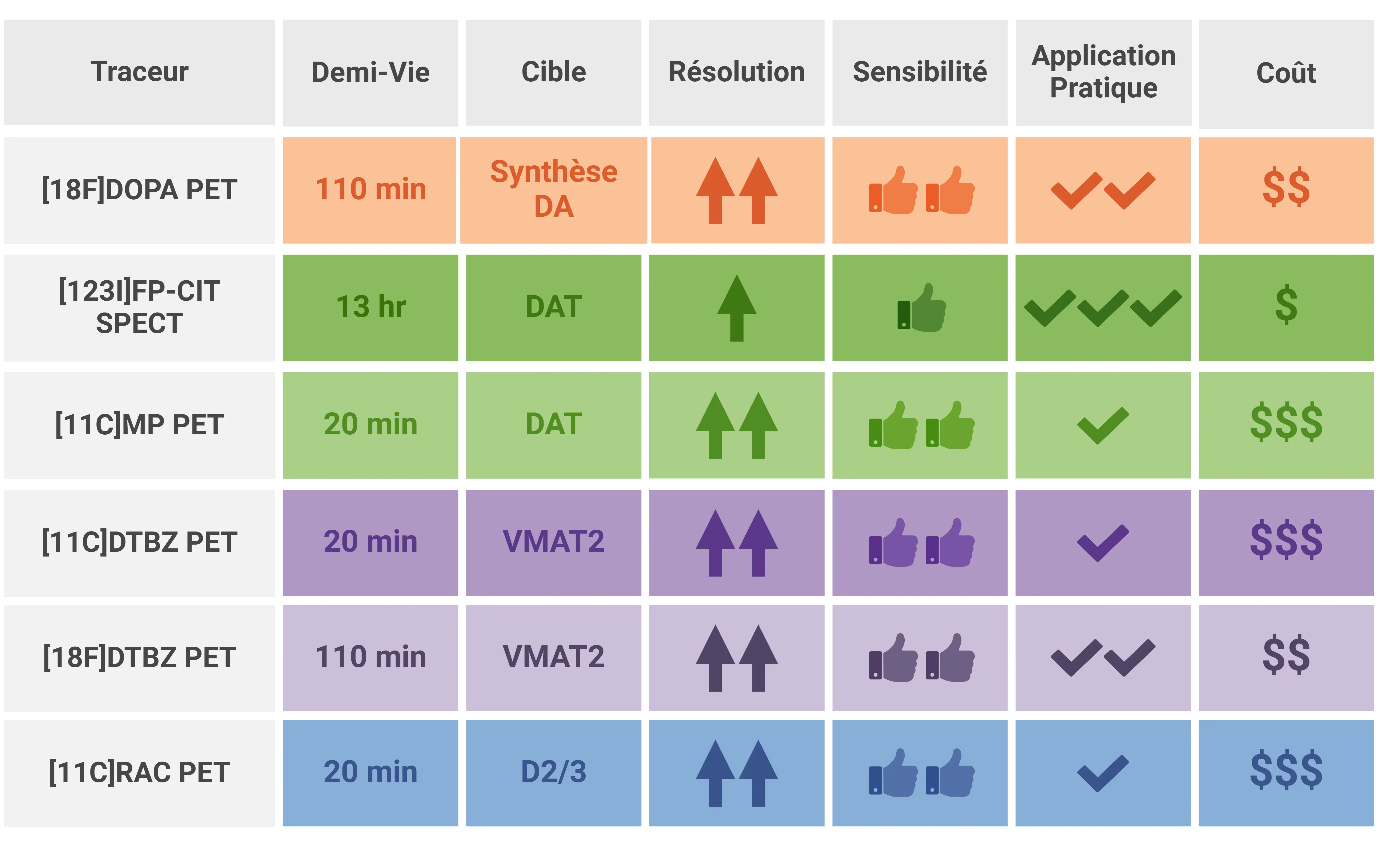
Résumé des différentes caractéristiques des radiotraceurs utilisés pour l'imagerie dopaminergique.
En résumé, même si la PET au [18F]DOPA est largement utilisée, la PET au DaTscan est avantageuse dans les essais cliniques sur les troubles du mouvement car elle mesure plus directement la synthèse de la dopamine, a une sensibilité plus élevée, offre une résolution spatiale d'imagerie considérablement plus élevée et a un temps de balayage réduit. Les limites dans ce contexte sont qu'il est plus coûteux et nécessite une installation de cyclotron à proximité. Les différents traceurs [11C] peuvent être utiles dans des études ciblées à petite échelle sur des sites de recherche dédiés, mais leur coût élevé et la nécessité d'une installation de cyclotron sur place limitent fortement leur applicabilité dans des essais cliniques multicentriques de plus grande envergure.
La [18F]DOPA PET est-elle un biomarqueur efficace pour surveiller la progression de la maladie dans la MP et d'autres troubles du mouvement?
Vue d'ensemble
Dans la maladie de Parkinson typique, l'absorption de [18F]DOPA dans les régions striatales diminue par rapport à l'état sain et aux syndromes atypiques de la maladie de Parkinson. Au cours de la phase clinique de la maladie, l'imagerie PET [18F]DOPA répétée dans des études longitudinales a démontré une diminution annuelle relativement constante de la captation du traceur dans le putamen, souvent de l'ordre de 8 à 12 % dans les stades précoces à modérés de la maladie, ce qui confirme l'efficacité de la PET [18F]DOPA pour quantifier et suivre les changements liés à la maladie (Nandhagopal, 2009). La diminution est généralement asymétrique, avec une perte de signal plus importante dans un hémisphère du cerveau (le côté controlatéral aux membres les plus affectés) par rapport à l'autre hémisphère (Whone, 2003; Kuriakose, 2010). En outre, le putamen postérieur est souvent plus affecté que le putamen antérieur, et ce gradient tend à se maintenir tout au long de l'évolution de la maladie (Nandhagopal, 2009; Ibrahim, 2016).
Bien que la plupart des études sur l'utilisation de la [18F]DOPA dans la MP se soient concentrées sur les régions striatales, en particulier le putamen et le noyau caudé, il existe également des preuves que l'absorption du traceur permettant de différencier les patients atteints de la maladie de Parkinson des témoins sains peut être détectée dans d'autres régions du cerveau, telles que le diencéphale, le tronc cérébral et d'autres régions corticales et sous-corticales, y compris l'amygdale (Smith, 2008).
La diminution de la captation striatale de [18F]DOPA est corrélée à la gravité de certains symptômes moteurs, en particulier la rigidité et la bradykinésie (Otsuka, 1996; Niethammer, 2012); cependant, la captation de [18F]DOPA ne semble pas être corrélée à tous les symptômes de la maladie de Parkinson. Par exemple, les symptômes non moteurs tels que les troubles cognitifs et la dépression, ainsi que certains symptômes moteurs, tels que les tremblements, ne sont pas bien corrélés, ce qui suggère qu'ils peuvent être causés par d'autres facteurs que la dégradation dopaminergique terminale (Otsuka, 1996; Broussolle, 1999).
L'un des principaux avantages du [18F]DOPA est sa sensibilité aux changements précoces de la signalisation de la dopamine dans le striatum. Avant même que les symptômes moteurs manifestes ne se manifestent, la PET au [18F]DOPA peut détecter de subtiles réductions de la synthèse dopaminergique, ce qui permet d'identifier les personnes présentant un risque plus élevé de progression vers une MP cliniquement évidente (Vingerhoets, 1994; Trujillo, 2025). Dans une étude plus ancienne, utilisant des mesures de la captation de [18F]DOPA chez des patients atteints de la maladie de Parkinson, prises à deux moments différents, à 18 mois d'intervalle, les auteurs ont estimé que la période préclinique (asymptomatique) moyenne de la maladie de Parkinson ne dépasse probablement pas 7 ans (Morrish, 1998; Hilker, 2005). Cependant, certains éléments indiquent que les mécanismes sous-jacents à l'absorption du traceur [18F]DOPA sont probablement différents entre l'apparition et la progression de la maladie, ce qui implique que l'évaluation des stratégies de modification de la maladie doit tenir compte de ces différences dans le cadre des essais cliniques (Nandhagopal, 2009). Cette même étude, basée sur le suivi de 78 patients avec des scanners de suivi à 4 et 8 ans, a démontré un déclin exponentiel de la fonction dopaminergique, avec le déclin le plus marqué au cours des 5 premières années suivant l'apparition des symptômes. Les auteurs soutiennent que pour caractériser ce déclin exponentiel, les données longitudinales sont essentielles et permettent de diviser par 5 la taille de l'échantillon nécessaire pour estimer les paramètres du déclin par rapport aux données transversales. Une méta-analyse plus récente (Kaasinen, 2017) a fait état de résultats similaires.
Utilisation de la PET [18F]DOPA comme biomarqueur dans les essais cliniques
L'objectif d'un biomarqueur dans l'étude des thérapies modificatrices de la maladie est en fin de compte de démontrer que le traitement préserve ou améliore les symptômes ou les résultats cliniques. Un biomarqueur peut être considéré comme un critère de substitution dans un essai clinique s'il (1) est en corrélation avec la progression clinique, voire l'anticipe, et (2) montre une supériorité par rapport aux mesures cliniques en termes de praticabilité, de précision, d'ampleur de l'effet, ou toute combinaison de ces éléments (van Eimeren, 2019). En termes de corrélation avec la progression clinique, de nombreuses études ont montré une forte concordance entre la PET [18F]DOPA et les scores moteurs de l'échelle unifiée de la maladie de Parkinson (UPDRS), tels que (Morrish, 1998; Pirker, 2003; Brooks, 2011; Kaasinen, 2017). Ces données soulignent le potentiel du [18F]DOPA non seulement pour le diagnostic, mais aussi pour le suivi de la progression de la maladie dans les troubles du mouvement.
Un certain nombre de manuscrits, de méta-analyses et de déclarations de position couvrant l'utilité potentielle de l'imagerie dopaminergique, et en particulier l'utilisation du [18F]DOPA comme biomarqueur, dans les essais cliniques ont été rédigés au fil des ans (Pirker, 2003; Maetzler, 2009; Nandhagopal, 2009; Niethammer, 2012; Kaasinen, 2017, 2019; Strafella, 2017; van Eimeren, 2019; Bidesi, 2021). En outre, l'initiative sur les marqueurs de progression de la maladie de Parkinson (PPMI) (Marek, 2011, 2018; Simuni, 2018) est une étude de recherche à long terme et à grande échelle qui vise à répondre à cette question et à d'autres questions relatives à l'évolution de la maladie de Parkinson. Bien que ces études montrent globalement un accord sur les caractéristiques de l'imagerie dopaminergique dans la MP et les troubles apparentés, en particulier la réduction striatale des neurones dopaminergiques, elles démontrent également une variabilité considérable. Cette variabilité serait due à plusieurs facteurs, tels que (a) la variabilité individuelle dans l'apparition, le stade et la progression de la maladie, (b) la variabilité inhérente aux études scientifiques avec de petits échantillons, et (c) la variabilité dans la méthodologie d'acquisition des données (Kaasinen, 2017).
Cependant, comme indiqué, le déclin assez important des neurones dopaminergiques dans la MP est bien décrit. Par exemple, un article fait état d'une diminution annuelle de 8,1% dans le putamen et de 6,3% dans le noyau caudé (Hilker, 2005), ce qui est comparable à ce que d'autres études ont constaté (Nurmi, 2001; Kaasinen, 2017). En revanche, le déclin chez les sujets sains serait inférieur à 2,5% par an (Maetzler, 2009). L'effet est encore plus fort dans les premiers stades de la MP, avec des rapports montrant une réduction d'au moins 30% de la captation de [18F]DOPA dans le putamen, de manière opposée aux symptômes cliniques (Jokinen, 2009). Ces ampleurs d'effet sont suffisamment importantes pour pouvoir détecter un effet du traitement même avec des échantillons de taille relativement faible, en particulier si l'effet du traitement entraîne le rétablissement de la fonction dopaminergique. Par exemple, plusieurs études sur la transplantation de cellules dopaminergiques (Nakamura, 2001; Ma, 2010) ont démontré des augmentations substantielles et significatives de la captation de [18F]DOPA dans des cohortes de 30 à 40 patients sur une période de 1 à 4 ans après la transplantation, atteignant plus de 40% d'augmentation de la captation sur une période de 4 ans.
La détermination de la taille des échantillons nécessaires pour détecter un effet du traitement dépend d'un certain nombre de facteurs et d'hypothèses, principalement l'ampleur de l'effet attendu, la variabilité de la mesure et le plan de l'étude. Dans une étude, la variabilité intra-sujet des mesures de la captation de la [18F]DOPA dans le striatum a été estimée entre 3 et 8% (selon la région anatomique d'intérêt [ROI] exacte) intra-sujet, et de 6 à 12% entre les sujets ; tandis que les variabilités extra-striatales étaient plus élevées, allant de 8 à 20% entre les sujets et de 6 à 20% au sein d'un même sujet, fortement dépendantes de la région d'intérêt (Egerton, 2010). Les auteurs notent que la variabilité relativement élevée dans les régions extra-striatales est probablement due au faible rapport signal/bruit dans ces zones. Notez que cette étude a été menée dans des conditions strictement contrôlées, avec des acquisitions uniformes toutes effectuées sur un seul site, ce qui entraînerait une variabilité considérablement moindre par rapport à une étude multi-sites. Mais pour illustrer, en supposant une taille d'effet cible de 10% et une variabilité de mesure de 10%, un essai clinique contrôlé par placebo aurait besoin d'au moins 16 sujets dans chaque bras pour pouvoir détecter un tel effet de traitement (en supposant une puissance de 80% et un niveau de signification de 0,05). Si la variabilité des mesures était en réalité de 20 à 40%, la taille de l'échantillon nécessaire pour détecter le même effet du traitement augmenterait à 63-142 sujets par bras, ce qui illustre l'importance de la réduction de la variabilité dans les essais cliniques, car cela se répercute directement sur le coût de l'essai.
Par rapport à DaTscan, le déclin annuel de la liaison de la DAT dans le putamen a été signalé comme étant similaire à celui évalué avec la PET [18F]DOPA (Benamer, 2000; Pirker, 2003); cependant, la variabilité de mesure de DaTscan est plus élevée en raison de la résolution plus faible, des méthodes de reconstruction d'image variables et de la variabilité plus élevée d'un site à l'autre, ce qui entraîne un besoin de 1,2 à 1,5 fois plus de participants dans un essai clinique typique (Seppi, 2006; Kägi, 2010; Brooks, 2011). En outre, une considération importante pour comparer DaTscan SPECT à la PET [18F]DOPA est également qu'en raison de la résolution d'imagerie plus élevée, la PET offre une meilleure discrimination régionale, améliorant en principe, par exemple, la capacité à identifier le gradient antéro-postérieur de l'absorption du traceur dans le putamen ou l'absorption différentielle entre le putamen et le noyau caudé (Khalil, 2011).
En résumé, le [18F]DOPA reste l'un des traceurs PET les plus établis et la norme de facto pour surveiller l'intégrité neuronale dopaminergique dans la MP et les troubles du mouvement associés, ce qui en fait un biomarqueur précieux pour la progression de la maladie lorsque l'infrastructure d'imagerie nécessaire est en place ou accessible (Tian, 2024). En outre, la PET [18F]DOPA est de plus en plus considérée pour une utilisation dans la pratique clinique standard (Walker, 2011).
Cependant, si la PET [18F]DOPA fournit des informations précieuses sur la synthèse de la dopamine, elle ne mesure pas directement d'autres aspects de la fonction dopaminergique, tels que la densité du transporteur de la dopamine (évaluée par DaTscan ou PET 11C-MP) ou le stockage vésiculaire (observé avec les traceurs DTBZ). Ainsi, il peut être plus informatif lorsqu'il est utilisé dans le cadre d'une approche multimodale, en complément potentiel d'autres traceurs ou évaluations cliniques (Nandhagopal, 2009); et de techniques d'analyse plus sophistiquées, telles que l'apprentissage profond (Zhao, 2022). L'application de la [18F]DOPA dans des essais cliniques multicentriques à grande échelle nécessite de réduire autant que possible les différentes sources de variabilité, par une sélection rigoureuse de la population de patients et une standardisation des protocoles d'acquisition et d'analyse (Whone, 2004).
Notre équipe se fera un plaisir de répondre à vos questions sur l'utilisation de la [18F]DOPA dans les essais cliniques sur la maladie de Parkinson ou de vous fournir des informations spécifiques sur nos autres services d'imagerie.
Découvrez nos services d'imagerie
Contenu connexe
Informations actualisées sur les meilleures pratiques liées à l'utilisation de la neuroimagerie dans les essais cliniques sur les maladies neurologiques.
Biomarqueurs TEP dans les essais cliniques sur la maladie de Huntington
Un aperçu de l'utilisation des biomarqueurs d'imagerie TEP pour les essais cliniques de la maladie de Huntington (MH).
Évolution longitudinale de la TEP Tau dans la MCI et la maladie d'Alzheimer
Vue d'ensemble de l'histoire naturelle de l'évolution de l'absorption et de la fixation du traceur de la TEP Tau dans les troubles cognitifs légers (MCI) et la maladie d'Alzheimer (AD).
La diminution du métabolisme du glucose cérébral dans la DCL est induite par la protéine Tau
Nous démontrons un rôle plus important de la protéine tau que de la β-amyloïde dans la réduction du métabolisme cérébral du glucose en analysant les images TEP de l'étude ADNI.
Méthode informatique pour l'harmonisation des images TEP du cerveau
Un nouvel algorithme pour normaliser la résolution spatiale des images de tomographie par émission de positons (TEP) du cerveau dans les essais cliniques multicentriques sans fantômes.