[18F]DOPAとは何ですか?
[18F]DOPA(フルオロドパ、18F-DOPA、[18F]F-DOPA、[18F]FDOPA、またはより正式には6-[18F]フルオロ-L-DOPA、6-[18F]FDOPA、または6-[18F]フルオロ-L-3,4-ジヒドロキシフェニルアラニン)は、ポジトロン断層撮影(PET)イメージングに使用される放射性医薬品です(Booij, 1999;Deng, 2002)。これは、運動、動機付け、報酬に関与する主要な神経伝達物質であるドーパミン(DA)の前駆体であるL-DOPAの標識形態です。
[18F]DOPAの主な用途は、脳内のドーパミン作動性システムの機能を評価することです。数十年前、生体内[18F]DOPA PETトレーサーの取り込みが、死後の脳検査におけるドーパミン細胞の数レベルを反映することが示されました(Snow, 1993)。それ以来、研究では一貫して、[18F]DOPAの取り込みの減少はパーキンソン病(PD)におけるドーパミン作動性ニューロンの損失、特に被殻における損失と相関することが示されています(Morrish, 1996, 1998;Hilker, 2005;Maetzler, 2009;Nandhagopal, 2009;Arya, 2024)。そのため、パーキンソン病などの運動障害の研究に有効なイメージングツールとして広く認識されています。パーキンソン病や関連する運動障害への応用以外にも、[18F]DOPAはハンチントン病の研究(Michler, 2019)や、腫瘍(神経膠腫など)の可視化と評価を目的とした腫瘍学への応用(Breen, 2022)にも使用されています。さらに、[18F]DOPA PETの使用は、線維筋痛症などの他の疾患についても評価されています(Ledermann, 2021)。
[18F]DOPAは、パーキンソン病の診断および本態性振戦とパーキンソン症候群の鑑別を目的として、2006年にEUで、2019年に米国で正式に承認されました(Chevalme, 2007; Dhawan, 2020; Dhawan, 2022)。この承認は、[18F]DOPAの臨床応用範囲を広げるという点で、重要なマイルストーンとなりました。 主な用途であるドーパミン作動性機能の研究以外にも、現在進行中の試験では、画像の質を向上させたり、他の集団や状態での使用を拡大することを目的としています(Abele, 2021)。さらに、[18F]DOPA PET イメージングは、脳内のドーパミン作動性活動および機能不全をマッピングできる能力があるため、統合失調症や気分障害などの精神疾患の管理における潜在的可能性を調査する研究も行われています(Cheng, 2020)。
[18F]DOPAは、例えばDaTscanなどの他のトレーサーと比較して、どのような利点や欠点がありますか?
メカニズム
まず、簡単にドーパミン作動性神経伝達について説明します。ドーパミンは、チロシン水酸化酵素(TH)によるL-チロシンの変換によりL-ドーパに合成され、続いて芳香族L-アミノ酸脱炭酸酵素(AADC)によりL-ドーパが脱炭酸されます(Meiser, 2013)。その後、シナプス小胞に貯蔵され、D2受容体を介してシグナル伝達が行われるためにシナプス間隙に放出されます。 ドーパミン輸送体(DAT)ポンプは、シナプス間隙から前シナプス神経細胞へのドーパミンの再取り込みを促進し、その後、VMAT2(小胞性モノアミン輸送体2)がドーパミンを再びシナプス小胞に積み込みます。 図に示されているように、異なる分子イメージングトレーサーは、ドーパミン作動性神経伝達経路に沿って異なる分子を標的(結合)とします。
。
ドーパミン作動性システムを研究するために使用されるさまざまな放射性トレーサーを示す神経末端。 [18F]DOPA は脱炭酸されて [18F]DA ([18F]ドーパミン) となり、シナプス小胞に貯蔵されます。VMAT-2(モノアミン輸送体2型)は[11C]DTBZまたは[18F]DTBZで標識され、ドーパミン輸送体(DAT)は[11C]MP(PET)または[123I]FP-CIT(DaTscan SPECT)で標識されます。ドーパミンD2/3受容体の利用可能性は、シナプスにおけるドーパミンレベルに敏感な[11C]RAC(ラクロプリド)で標識することができます。
[18F]DOPAは主にドーパミンの合成と貯蔵を反映するため、シナプス前部におけるドーパミン作動性機能に関する情報を提供します(Morrish, 1996;Heiss, 2004)。一方、[123I]FP-CIT(DaTscan SPECTに使用されるトレーサー)はドーパミン輸送体(DAT)に結合するため、シナプス前部におけるドーパミン終末の完全性と密度を反映し、(Booij, 1999;Seppi, 2006;Kägi, 2010)。 特定の研究でどのトレーサーが使用されるかは、薬剤候補の特定の仮説や作用機序、薬剤誘発性の変化に対するトレーサーの予想される特異性や感度、その他の研究計画の考慮事項など、いくつかの要因によって異なります(Bidesi, 2021)。
同じプロセスを標的とする他の一般的なPETトレーサーには、11C-DTBZ ([11C]dihydrotetrabenazine) と18F-DTBZ ([18F]DTBZ、一般的にAV-133またはflorbenazineとして知られている) があります両方とも、ドーパミンなどの神経伝達物質をシナプス前小胞にパッケージ化する役割を担う、小胞性モノアミン輸送体2(VMAT2)に結合します(Stoessl, 2012;Marek, 2018)。11C-RAC ([11C]raclopride) は主にシナプス後部のドーパミン受容体に結合し、薬剤がD2/3受容体を占める方法を決定するために頻繁に使用されます(Volkow,1994年、 Boileau, 2007年); および、線条体の DAT 部位に結合する DAT 阻害剤である 11C-MP ([11C]methylphenidate)(Morrish, 1998年、Volkow, 2002年、Nandhagopal, 2009年)です。
実用性
DaTscan SPECT は、比較的安価で幅広い認可を受け、臨床的にも広く応用できることから、パーキンソン症候群の研究に広く使用されています。 [123I] トレーサーの比較的長い半減期(約 13 時間)により、広範囲への輸送が可能となり、多施設臨床試験における患者のスキャン実施のロジスティクスを支援します。一方、11C-DTBZ、11C-RAC、11C-MPに使用される[11C]トレーサーは半減期が非常に短く(約20分)、これらのトレーサーを使用したPETスキャンには、施設内にサイクロトロンが必要となります。これは多施設臨床試験にとって大きな実用上の障害となります。[18F]DOPAおよび[18F]DTBZ PETに使用されるフッ素-18の半減期は約110分であり、DaTscanと比較すると依然として比較的短いものの、[11C]よりもはるかに柔軟性があります。
PETがDaTscanと比較して優れている点として、画像の空間分解能が挙げられます。DaTscan SPECTの画像分解能は一般的に7~8mm程度と低いのに対し、PETスキャンでは4~5mm、あるいはそれ以上の空間分解能で画像を取得でき、これにより取得画像の解剖学的特異性が高まります(Rahmim, 2008;Khalil, 2011)。さらに、[18F]DOPAは、AADCによる取り込みと変換を通じて、ドーパミンの合成を直接測定できるという利点があり、これが早期発見におけるその使用を裏付けています。この特性により、早期パーキンソン病の研究やドーパミン作動性神経細胞の合成能力の評価に最適です。一方、DaTscan SPECTは主にパーキンソン病の臨床診断や、パーキンソン病と他の運動障害の鑑別に使用されます。[18F]DOPA PETは、疾患の進行や治療効果の評価に適しています。
さらに、[18F]DOPAはDaTscan SPECTよりも大幅な利点があります。スキャン時間はDaTscanの30~45分に対して10~20分と大幅に短縮されています。また、また、[18F]DOPA PETでは、注射後の時間(トレーサーの注射からスキャンセッションまでの時間)が大幅に短縮されます(60~90分に対し、3~6時間)。特に運動障害のある患者集団では、準備とスキャン時間を短縮することは、画像データの質にとって極めて重要です。
以下の表は、これらのトレーサーのさまざまな側面をまとめたものです。
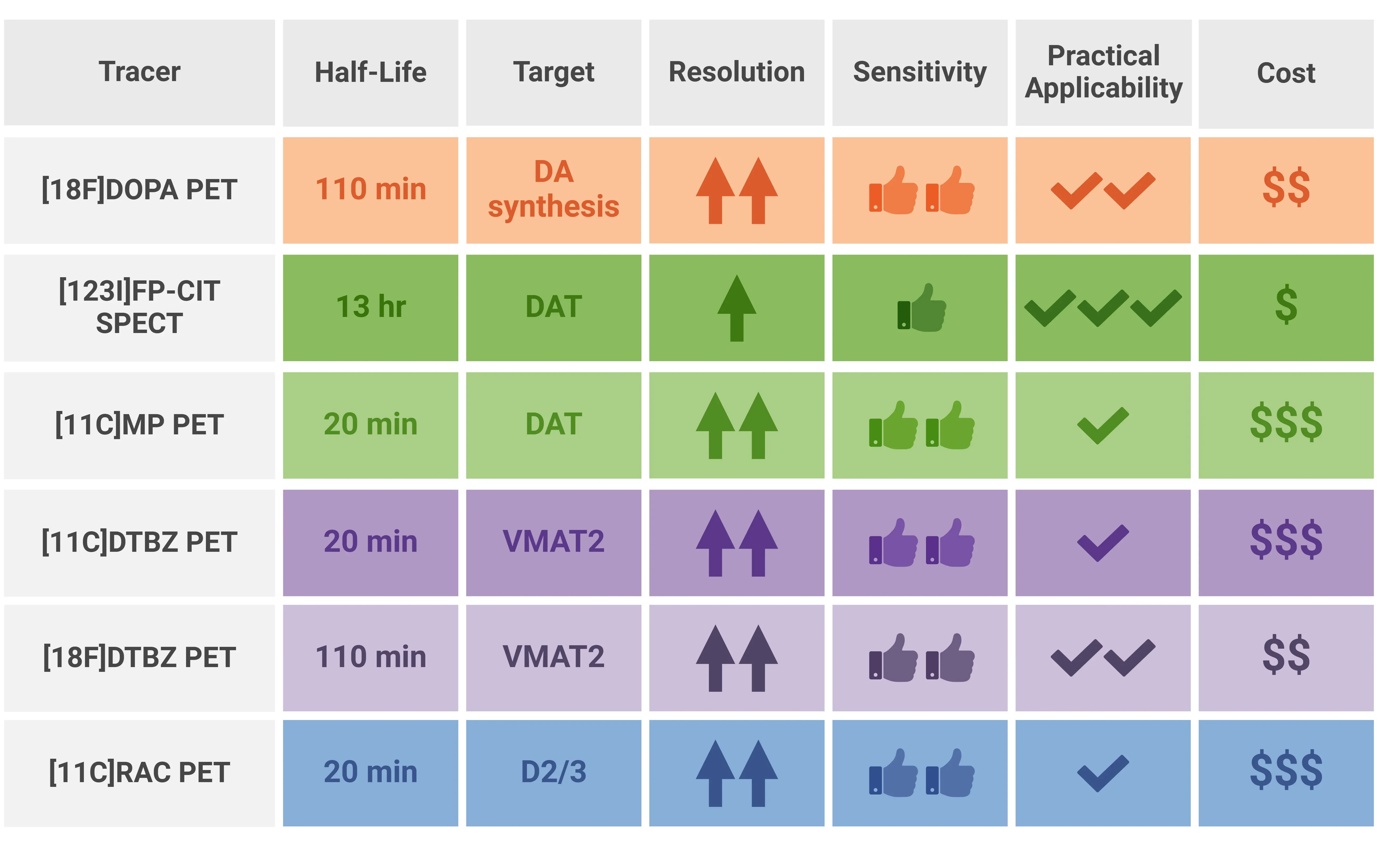
ドーパミン作動性イメージングに使用される放射性トレーサーのさまざまな特徴のまとめ。
まとめると、DaTscan SPECT も広く使用されていますが、運動障害の臨床試験では、[18F]DOPA PET は、より直接的にドーパミン合成を測定し、感度が高く、画像の空間分解能がかなり高く、スキャン時間が短いという利点があります。この点における制限は、コストが高く、近隣にサイクロトロン施設が必要であることです。様々な[11C]トレーサーは、専門の研究施設における小規模な研究には有用ですが、コストが高く、施設内にサイクロトロン施設が必要であるため、大規模な多施設臨床試験への適用は大幅に制限されます。
[18F]DOPA PETは、運動障害における疾患進行のモニタリングに有効なバイオマーカーとなり得るか?
概要
典型的なPDでは、線条体領域における[18F]DOPAの取り込みは、健康な状態や非定型パーキンソン症候群と比較して減少します。臨床段階では、縦断的研究における[18F]DOPA PET画像診断を繰り返し実施したところ、被殻におけるトレーサーの取り込みが、早期から中程度の疾患では、多くの場合8~12%の範囲で、毎年比較的安定して減少することが示されました。これは、[18F]DOPA PETが疾患関連の変化を定量化し追跡する上で有効であることを裏付けるものです(Nandhagopal, 2009)。減少は通常非対称で、信号損失は脳の片半球(より影響を受けている手足と反対側)の方が他半球よりも大きくなります(Whone, 2003;Kuriakose, 2010)。さらに、後部被殻は前部被殻よりも影響を受けやすく、その勾配は疾患の経過を通じて維持される傾向があります(Nandhagopal, 2009;Ibrahim, 2016)。
パーキンソン病における[18F]DOPAの使用に関するほとんどの研究は、線条体の領域、特に被殻と尾状核に焦点を当てていますが、パーキンソン病患者と健常者の識別に役立つトレーサーの取り込みが、間脳、脳幹、および扁桃体を含む他の皮質および皮質下の領域など、他の脳領域でも検出されるという証拠もあります(Smith, 2008)。
線条体の[18F]DOPA取り込みの減少は、特定の運動症状、特に固縮および動作緩慢の重症度と相関しています(Otsuka, 1996;Niethammer, 2012)。しかし、[18F]DOPA取り込みはパーキンソン病のすべての症状と相関しているわけではないようです。例えば、認知障害やうつ病などの非運動症状、および振戦などの一部の運動症状は相関性が低く、これは、それらの症状がドパミン作動性終末の分解以外の要因によって引き起こされている可能性を示唆しています(Otsuka, 1996;Broussolle, 1999)。
[18F]DOPAの主な利点のひとつは、線条体におけるドーパミン信号の早期変化に対する感度の高さです。明らかな運動症状が現れる前でも、[18F]DOPA PETはドーパミン合成のわずかな減少を検出でき、臨床的に明らかなパーキンソン病への進行リスクが高い患者を特定できる可能性があります(Vingerhoets, 1994;Trujillo, 2025)。以前の研究では、18ヶ月間隔で2回測定したPD患者の[18F]DOPA取り込み測定値を使用し、著者らはPDの平均的な無症候期(臨床症状が現れる前の期間)は7年以内であろうと推定しました(Morrish, 1998;Hilker, 2005)。しかし、[18F]DOPAトレーサーの取り込みのメカニズムは、発症時と進行時ではおそらく異なる可能性があることを示す兆候があり、臨床試験の設定では、疾患修飾戦略の評価にはこれらの相違を考慮すべきであることを示唆しています(Nandhagopal, 2009)。同じ研究では、4年および8年間の追跡調査を受けた78人の患者を対象に、症状発症後最初の5年間で最も急激な減少が見られる、ドーパミン作動性機能の指数関数的な低下が示されました。著者は、この指数関数的な低下を特徴づけるためには縦断的データが不可欠であり、横断的データと比較して、低下のパラメータを推定するために必要なサンプルサイズを最大5分の1に減らすことができると主張しています。より最近のメタアナリシス(Kaasinen, 2017)でも同様の結果が報告されています。
臨床試験におけるバイオマーカーとしての[18F]DOPA PETの使用
疾患修飾療法の研究におけるバイオマーカーの目標は、最終的にはその治療法が症状や臨床結果を維持または改善することを実証することです。バイオマーカーは、(1) 臨床的進行と相関し、場合によってはそれを予測し、(2) 臨床的測定よりも実用性、精度、効果の大きさ、またはこれらの組み合わせのいずれかの点で優れている場合、臨床試験における代替エンドポイントとして適格である可能性があります(van Eimeren, 2019)。臨床的進行との相関性という観点では、多くの研究で[18F]DOPA PETと運動スコアの統一パーキンソン病評価尺度(UPDRS)との強い一致が示されています(Morrish, 1998;Pirker, 2003;Brooks, 2011;Kaasinen, 2017)。このデータは、[18F]DOPAが診断だけでなく、運動障害の進行モニタリングにも有用である可能性を示しています。
臨床試験におけるドパミン作動性画像診断の潜在的有用性、特にバイオマーカーとしての[18F]DOPAの使用について、長年にわたり多くの論文、メタアナリシス、見解が発表されています(Pirker, 2003;Maetzler, 2009;Nandhagopal, 2009;Niethammer, 2012;Kaasinen,2017年、 2019年;Strafella, 2017年;van Eimeren, 2019年;Bidesi, 2021年)。さらに、パーキンソン病進行マーカー・イニシアチブ(PPMI)(Marek, 2011,2018;Simuni, 2018)は、PDの経過に関するこれらの疑問やその他の疑問の解決を目的とした、長期にわたる大規模な研究です。これらの研究全体では、PDおよび関連疾患におけるドーパミン作動性イメージングの特徴、特に線条体のドーパミン作動性ニューロンの減少について一致した見解が示されていますが、かなりのばらつきがあることも示されています。このばらつきは、(a) 発症、病期、進行における個体差、(b) サンプルサイズが小さい科学的研究に内在するばらつき、(c) データ取得方法におけるばらつきなど、いくつかの要因によるものと考えられています(Kaasinen, 2017)。
しかし、前述の通り、PDにおけるドーパミン作動性ニューロンのかなり強い減少はよく知られています。例えば、ある論文では、被殻で年間8.1%、尾状核で6.3%の減少が報告されています(Hilker, 2005)。これは、他の研究で発見されたもの(Nurmi, 2001;Kaasinen, 2017)と比較しても遜色ありません。一方、健康な対照群では、毎年2.5%未満の減少であると報告されています(Maetzler, 2009)。早期パーキンソン病ではさらに効果が強く、臨床症状と反対側の被殻における[18F]DOPA取り込みが少なくとも30%減少したという報告もあります(Jokinen, 2009)。 これらの効果の大きさは、比較的小規模なサンプルサイズでも治療効果を検出できるほど十分に大きく、特に治療効果がドーパミン作動性機能の回復をもたらす場合はその傾向が顕著です。例えば、ドーパミン作動性細胞移植に関する複数の研究(Nakamura, 2001;Ma, 2010)では、移植後1~4年間にわたる30~40人の患者集団において、[18F]DOPAの取り込みが大幅かつ有意に増加することが実証されています。4年間の取り込み増加率は40%を超えています。
治療効果を検出するために必要なサンプルサイズを決定するには、多くの要因や仮定、主に期待される効果の大きさ、測定のばらつき、研究デザインに依存します。ある研究では、線条体の[18F]DOPA取り込み測定における被験者内でのばらつきは、被験者内では3~8%(正確な解剖学的関心領域[ROI]による)の範囲内、また、被験者間では6~12%でした。一方、線条体外のばらつきはさらに大きく、被験者間では8~20%、被験者内では6~20%でした。これはROIに強く依存しています(Egerton, 2010)。著者らは、線条体外領域における比較的高い変動性は、これらの領域における信号対雑音比が低いことが原因である可能性が高いと指摘しています。この研究は厳密に管理された条件下で実施され、すべての取得は単一の施設で行われたため、多施設研究と比較すると変動性はかなり低くなります。しかし、例を挙げると、仮に目標効果サイズを10%、測定のばらつきを10%と想定した場合、プラセボ対照臨床試験では、そのような治療効果を検出するには、各群に少なくとも16人の被験者が必要となります(検出力80%、有意水準0.05と仮定)。実際には測定のばらつきが20~40%であった場合、同じ治療効果を検出するために必要なサンプル数は、各群あたり63~142人に増加します。臨床試験におけるばらつきの低減が重要であることを示す例であり、それはそのまま試験費用に直結します。
DaTscanと比較すると、被殻におけるDAT結合の年間減少率は[18F]DOPA PETで評価されたものと類似していることが報告されています(Benamer, 2000; Pirker, 2003)。しかし、DaTscanの測定のばらつきは、解像度の低さ、画像再構成方法のばらつき、部位間のばらつきが原因で高くなり、そのため、通常の臨床試験では、被験者数を1.2~1.5倍に増やす必要があります(Seppi, 2006;Kägi, 2010;Brooks, 2011)。さらに、DaTscan SPECTと[18F]DOPA PETを比較する上で重要な考慮事項として、PETは画像解像度が高いため、原理的には、例えば被殻におけるトレーサー取り込みの前後勾配の識別能力や、被殻と尾状核間の取り込みの差異の識別能力が向上します(Khalil, 2011)。
まとめると、[18F]DOPAは依然として最も確立されたPETトレーサーのひとつであり、事実上の標準として、必要な画像インフラが整っているか利用可能な場合に、パーキンソン病および関連する運動障害におけるドーパミン神経系の完全性をモニタリングするのに役立つ、疾患進行の貴重なバイオマーカーとなります(Tian, 2024)。さらに、[18F]DOPA PET は標準的な臨床診療での使用もますます検討されるようになってきています(Walker, 2011)。
しかし、[18F]DOPA PETはドーパミン合成に関する貴重な情報を提供しますが、ドーパミン輸送体の密度(DaTscanまたは11C-MP PETで評価)や小胞貯蔵(DTBZトレーサーで確認)など、他のドーパミン作動性機能の側面を直接測定するものではありません。そのため、多様なアプローチの中で使用される場合、他のトレーサーや臨床評価を補完する可能性があり、最も有益であると考えられます(Nandhagopal, 2009)。また、ディープラーニング(Zhao, 2022)などのより高度な分析技術も有効です。大規模な多施設臨床試験における[18F]DOPAの適用には、患者集団の慎重な選択と取得および分析プロトコルの標準化を通じて、さまざまな変動要因を可能な限り低減する必要があります(Whone, 2004)。
パーキンソン病の臨床試験における[18F]DOPAの使用に関するご質問や、当社のその他のイメージングサービスに関する具体的な情報提供など、どのようなご質問にも喜んでお答えいたします。
当社のイメージングサービスについてさらに詳しく知る
関連コンテンツ
神経疾患の臨床試験における神経画像診断の使用に関するベストプラクティスの最新情報。
ハンチントン病臨床試験におけるPETイメージング
ハンチントン病(HD)の臨床試験におけるPETイメージングバイオマーカーの使用に関する概要。
MCIとアルツハイマー病におけるタウPETの経時的変化
軽度認知障害(MCI)およびアルツハイマー病(AD)におけるタウPETトレーサーの取り込みと結合の変化に関する自然史の概要。