Cette ressource décrit:
- Quels sont les traceurs TEP de la protéine Tau qui ont été évalués dans les études sur la MCI et la MA?
- Comment la TEP-Tau se compare-t-elle à d'autres biomarqueurs de la protéine tau pour prédire la progression de la maladie?
- Quel est le schéma spatio-temporel de l'accumulation du traceur Tau PET?
- Des modifications de la TEP de la protéine Tau ont-elles été mises en évidence dans les essais cliniques sur la MCI/la MA?
Quels sont les traceurs TEP de la protéine Tau qui ont été évalués dans les études sur la MCI et la MA?
Bien que les caractéristiques histopathologiques de la maladie d'Alzheimer (MA) soient depuis longtemps reconnues comme étant la présence de plaques de bêta-amyloïde (Aβ) et d'enchevêtrements neurofibrillaires dans le cerveau, ce n'est que récemment (2020) que la FDA a approuvé le premier traceur TEP Tau, le [18F]flortaucipir (également connu sous le nom d'AV-1451 ; Tauvid™) pour estimer la densité et la distribution des enchevêtrements neurofibrillaires tau agrégés chez les adultes atteints de troubles cognitifs évalués pour la MA (Barthel, 2020). Les principales limites de ce ligand sont (1) sa faible sensibilité aux stades tau plus précoces et aux tauopathies non-Alzheimer, telles que la dégénérescence corticobasale (CBD) et la paralysie supranucléaire progressive (PSP) (Soleimani-Meigooni, 2020), et (2) la présence d'une liaison hors cible, en particulier à l'enzyme monoamine oxydase B (MAO-B), qui peut limiter les applications cliniques de routine (Leuzy, 2019). Des recherches actives sont en cours sur les ligands de deuxième génération, tels que le [3H]PI2620, le [3H]RO948, le [3H]MK-6240 et le [3H]JNJ067 (Bischof, 2021; Yap, 2021), qui montrent des résultats prometteurs pour surmonter ces limitations. Une récente étude approfondie du flortaucipir (Burnham, 2024) a conclu que, malgré ses limites, le flortaucipir est un marqueur in vivo précis et utile des enchevêtrements neurofibrillaires de tau qui peut améliorer le diagnostic, et potentiellement le pronostic, de la maladie d'Alzheimer. Toutefois, l'utilisation d'un ligand de deuxième génération ([18F]MK-6240) très sensible aux enchevêtrements neurofibrillaires de tau pourrait permettre de détecter plus tôt les dépôts longitudinaux de tau chez les personnes ne présentant pas de troubles cognitifs (Pascoal, 2021).

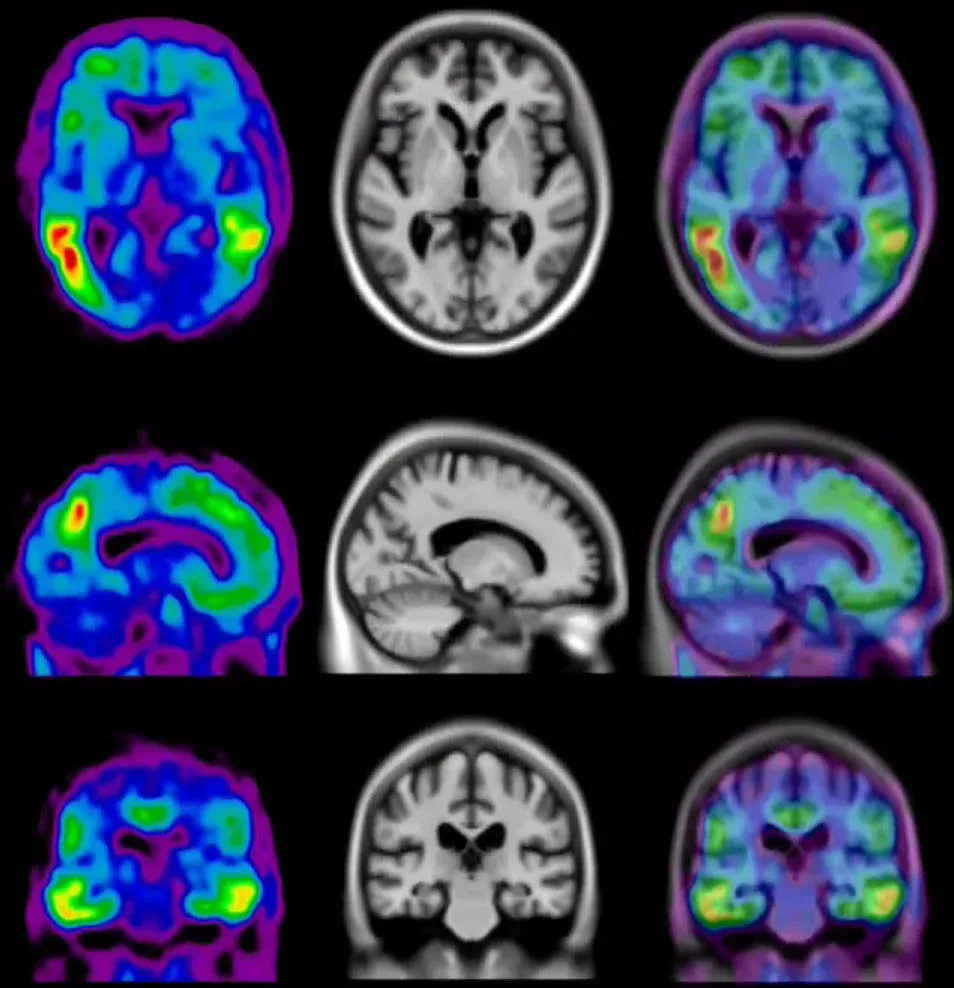
Projections de surface des signaux TEP moyens de l'amyloïde et de la tau observés dans une cohorte de patients atteints de la maladie d'Alzheimer. Les encarts illustrent la coloration par immunohistochimie (IHC) d'une plaque de bêta-amyloïde (à gauche) et d'inclusions et d'enchevêtrements intraneuronaux de tau (à droite).
Comment la TEP Tau se compare-t-elle aux autres biomarqueurs de la protéine tau pour prédire la progression de la maladie?
Coomans et al. (Coomans, 2023) ont récemment montré que la TEP-Tau reste le meilleur prédicteur du déclin cognitif par rapport à plusieurs autres biomarqueurs, tels que la protéine tau plasmatique (pTau181), l'atrophie corticale à l'imagerie par résonance magnétique (IRM), la cognition de base, le statut du gène de l'apolipoprotéine E (APOE), les niveaux de tau-217 phosphorylé dans le plasma et le liquide céphalorachidien (LCR), la chaîne légère du neurofilament (NfL) ou le rapport amyloïde-bêta (Aβ)42/40 (Smith, 2023).
Cependant, les marqueurs plasmatiques de tau pourraient être très utiles pour enrichir les études cliniques (Blennow, 2023). Il a été démontré que le plasma p-tau181 peut prédire l'agrégation tau très précoce liée à la MA et, en tant que tel, peut être pertinent pour les essais utilisant des médicaments ciblant la protéine tau, étant donné qu'il crée la possibilité d'inclure des individus positifs à l'amyloïde, négatifs à la protéine tau et présentant un risque accru d'accumulation imminente de protéine tau dans ces essais qui sont conçus pour arrêter la progression de la protéine tau aux premiers stades et potentiellement prévenir la cascade subséquente de neurodégénérescence et de déficience cognitive. Une telle présélection pourrait également réduire le nombre de patients à recruter pour détecter le même effet du médicament (Ferreira, 2023).
Quel est le schéma spatio-temporel de l'accumulation du traceur Tau PET?
Les études histopathologiques pionnières de Braak et de ses collègues (Braak, 1991) ont révélé un schéma caractéristique de dépôt d'enchevêtrements neurofibrillaires intraneuronaux dans la MA. Une progression stéréotypée de la pathologie, illustrée ci-dessous, se produit des stades transentorhinaux (stades I/II de Braak) à un stade limbique (stades III/IV de Braak) et enfin à un stade néocortical (stades V/VI de Braak). Des études sur le [18F]flortaucipir (AV-1451) ont montré qu'une augmentation précoce des dépôts de tau dans les régions des stades Braak I/II présentant un statut anormal de bêta-amyloïde permet déjà d'identifier les individus dont la cognition commence à se détériorer (Chen, 2021). Un déclin plus rapide des performances de la mémoire a été associé à des taux plus rapides d'accumulation de tau dans l'ensemble du spectre de la MA (Jack, 2020). Chez les personnes ne présentant pas de troubles cognitifs, c'est dans le cortex temporal inférieur que l'on observe la plus forte accumulation au fil du temps (Insel, 2023). Bien que le système de stades de Braak soit une bonne description de la propagation de la protéine tau au niveau de la population, des exemples sont apparus de profils individuels de la protéine tau qui ne correspondent pas exactement à ce modèle (Ossenkoppele, 2016). Ainsi, une vaste étude portant sur des individus positifs à la TEP Tau a révélé que différentes trajectoires de dépôt de tau sont associées à une évolution différente des troubles cognitifs, ce qui pourrait être important à prendre en compte pour la conception de futurs essais (Vogel, 2021).
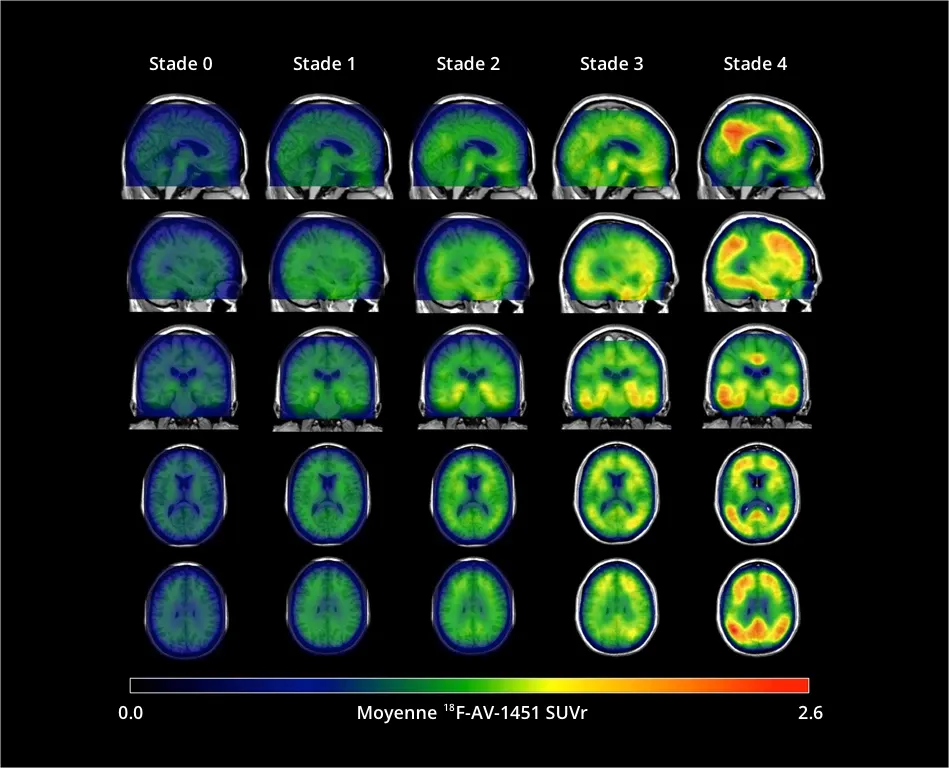
Le signal du [18F]flortaucipir (AV-1451) (rapport normalisé de la valeur d'absorption) augmente dans l'ensemble du cortex et du sous-cortex du stade 0 au stade 4. Les participants au stade 0 avaient des niveaux de tau correspondant à ceux de jeunes adultes normaux. Une élévation dominante de la protéine tau dans les régions temporales médianes (régions d'intérêt de Braak I/II) a été observée au stade 1. Alors que le stade 2 présentait une augmentation du SUVR dans les régions temporales extra-médianes, le stade 3 présentait une augmentation plus importante du SUVR dans les régions d'intérêt Braak III/IV, y compris les lobes temporaux inférieurs et latéraux. Le stade 4 présentait un SUVR du [18F]AV-1451 significativement élevé, s'étendant au néocortex. Illustration dérivée de Chen et al., 2021 sous la licence Creative Commons Attribution License).
La complexité de la dissection de l'hétérogénéité régionale spécifique au sujet et de l'accumulation longitudinale de tau peut être surmontée en utilisant des régions d'intérêt (ROI) spécifiques au sujet, par opposition à l'utilisation des mêmes ROI pour tous les sujets pour l'analyse du traceur TEP. Il a été démontré que cette approche permet une augmentation significative de la détection du changement annuel du SUVR Tau pour tous les groupes cliniques, ce qui a entraîné une réduction significative de la taille de l'échantillon (Leuzy, 2023).
Des changements dans la TEP Tau ont-ils été mis en évidence dans les essais cliniques sur la MCI/la MA?
Le succès historiquement limité des thérapies ciblant la bêta-amyloïde a conduit à une évolution vers le développement de thérapies ciblant la protéine tau. Plusieurs stratégies thérapeutiques potentielles sont actuellement étudiées pour le traitement des tauopathies, telles que la clairance médiée par les anticorps, la réduction de l'expression génétique et l'inhibition par de petites molécules (Singh, 2024).
La majorité des agents thérapeutiques actuellement étudiés se concentrent sur l'immunothérapie de la protéine tau. Les premiers essais de phase 2 sur la clairance médiée par les anticorps qui incluaient la TEP de la protéine tau comme critère exploratoire (par exemple, zagotenemab, gosuranemab) n'ont pas montré de changement significatif dans le changement moyen ajusté du rapport de la valeur de prise standardisée (SUVR) de la TEP de la protéine tau (Fleisher, 2024; Shulman, 2023). Un anticorps (E2814) a démontré une sécurité, une pharmacocinétique et un profil d'engagement de la cible CSF prometteurs chez les participants atteints de la maladie d'Alzheimer à transmission héréditaire dominante, et il est actuellement étudié dans le cadre d'un essai de phase 3 dont le principal critère d'évaluation est un changement du signal Tau PET (Zhou, 2023).
En termes de réduction de l'expression génétique, les oligonucléotides antisens (ASO) peuvent constituer une approche thérapeutique prometteuse. Une étude de phase 1 utilisant un oligonucléotide antisens ciblant la protéine tau (MAPT-RX) a montré une réduction dose-dépendante de la concentration totale de tau dans le LCR (Mummery, 2023), tandis qu'une étude de phase 2 du BIIB080 (MAPT-Rx) est actuellement en cours avec des résultats préliminaires montrant une réduction du signal Tau PET dans toutes les régions du cerveau évaluées (Edwards, 2023).
À notre connaissance, aucun résultat d'essai clinique utilisant l'inhibition de la protéine tau par une petite molécule en tant qu'agent thérapeutique et incluant une modification de la TEP Tau comme critère d'évaluation n'a été publié (en septembre 2024). Cependant, il est probable que la prochaine génération d'essais intégrera la TEP-Tau, car elle a été jugée essentielle pour les stratégies de biomarqueurs des essais cliniques ciblant la protéine tau (Penny, 2024).
Notre équipe se fera un plaisir de répondre à vos questions sur l'évolution longitudinale de la TEP Tau dans la MCI et la maladie d'Alzheimer ou de vous fournir des informations spécifiques sur nos autres services d'imagerie.
Découvrez nos services d'imagerie
Contenu connexe
Informations actualisées sur les meilleures pratiques liées à l'utilisation de la neuroimagerie dans les essais cliniques sur les maladies neurologiques.
[18F]DOPA PET dans les essais cliniques sur la maladie de Parkinson
Comment la [18F]DOPA PET est utilisée pour surveiller la progression de la maladie et la réponse à l'intervention thérapeutique dans les essais cliniques sur la maladie de Parkinson et les troubles du mouvement.
Modélisation du mauvais repliement des protéines dans les maladies neurologiques
Modélisation informatique des mécanismes de mauvais repliement des protéines dans la neurodégénérescence et application à la découverte et au développement de traitements modificateurs de la maladie.
La neuroimagerie dans la démence frontotemporale et les essais cliniques
L'utilité des biomarqueurs d'imagerie IRM et TEP dans notre compréhension des variantes de la démence frontotemporale (DFT) et leur utilisation comme critères d'évaluation dans les essais cliniques sur la DFT.
Essais cliniques sur les lésions renforcées par le gadolinium en IRM dans la SP
Comment les lésions rehaussées par le gadolinium (Gd) sont utilisées pour suivre la progression de la maladie et la réponse à l'intervention thérapeutique dans les essais cliniques sur la sclérose en plaques (SP).
Biomarqueurs d'imagerie pour la paralysie supranucléaire progressive (PSP)
Aperçu des différentes méthodes d'imagerie cérébrale (IRM, PET, SPECT) disponibles pour évaluer l'efficacité des traitements de fond dans les essais cliniques sur la PSP.
Biomarqueurs d'imagerie pour distinguer la CBD des autres tauopathies
Vue d'ensemble des biomarqueurs d'imagerie cérébrale permettant d'identifier les sujets atteints de dégénérescence corticobasale (CBD) et de leur utilisation dans le cadre d'essais cliniques de traitements modificateurs de la maladie.
L'IRM dans les essais cliniques sur l'atrophie du système multiple (MSA)
Cette ressource donne un aperçu de l'utilité de l'IRM volumétrique et de l'imagerie pondérée en diffusion (DWI) en tant que biomarqueurs dans les études de recherche sur la MSA.