Cette ressource décrit :
Quelles sont les caractéristiques cliniques et les causes génétiques de l'ataxie spinocérébelleuse?
L'ataxie spinocérébelleuse (SCA) désigne un groupe hétérogène de plus de 40 maladies neurodégénératives rares, à transmission autosomique dominante. Ces troubles se caractérisent par une dégénérescence progressive du cervelet, du tronc cérébral et de la moelle épinière. L'ataxie, qui est le symptôme clinique le plus courant et souvent le plus précoce, est généralement évaluée à l'aide de l'échelle SARA (Scale for the Assessment and Rating of Ataxia), qui mesure la gravité de la maladie (Schmitz-Hübsch, 2006). L'ataxie s'accompagne généralement d'une instabilité de la démarche, d'une incoordination des membres, d'anomalies oculomotrices et d'une dysarthrie (difficulté à parler) (Rossi, 2014; Cui, 2024). Les patients peuvent également connaître une phase pré-ataxique, qui peut durer plusieurs années avant l'apparition de symptômes ataxiques perceptibles. Au cours de cette phase, des déficits subtils de coordination et des anomalies cérébrales se développent progressivement (Brooker, 2021; Cui, 2024). Au fur et à mesure que la maladie progresse, les patients peuvent également présenter des symptômes non ataxiques, tels que des troubles cognitifs, de la spasticité, de la rigidité et de la dystonie (Brooker, 2021). Ces symptômes peuvent entraîner une morbidité importante, de nombreux patients finissant par se déplacer en fauteuil roulant et par mourir prématurément.
La classification des SCA suit un système numérique basé sur l'ordre dans lequel les mutations génétiques ont été découvertes. Les formes les plus courantes sont celles associées à des expansions de répétitions CAG codant pour des polyglutamines (polyQ), à savoir les SCA1, SCA2, SCA3, SCA6, SCA7 et SCA17, qui sont les plus étudiées puisqu'elles représentent plus de la moitié de tous les cas connus (Brooker, 2021). Les sous-types SCA3 (également connu sous le nom de maladie de Machado-Joseph), SCA2 et SCA6 sont les plus répandus (Afonso-Reis, 2021). En revanche, d'autres SCA résultent de l'expansion de répétitions non codantes, notamment les SCA8, SCA10, SCA12, SCA27B, SCA31, SCA36 et SCA37. Les autres SCA sont liés à des mutations ponctuelles dans des gènes spécifiques (Cui, 2024). La SCA se manifeste généralement au début de l'âge adulte, souvent autour de la quatrième décennie de la vie, bien que l'âge d'apparition puisse varier considérablement (Rossi, 2014; Afonso-Reis, 2021). Pour les SCA causées par des expansions répétées, un facteur critique influençant l'âge d'apparition et la sévérité des symptômes est la longueur de l'expansion répétée, les répétitions plus longues étant généralement associées à une apparition plus précoce et à une progression plus sévère (Brooker, 2021).
La mise au point de traitements efficaces pour les SCA est particulièrement difficile en raison de la diversité de leur pathogénie sous-jacente. En outre, les phénotypes cliniques peuvent se chevaucher entre différents sous-types de SCA, ce qui rend les tests génétiques essentiels pour un diagnostic définitif. En outre, les taux de progression varient d'un génotype à l'autre. Par exemple, l'ataxie tend à progresser plus rapidement dans le SCA1, à un rythme intermédiaire dans le SCA2 et le SCA3, et plus lentement dans le SCA6 (Diallo, 2021). En outre, la rareté des SCA, qui touchent environ 1 à 5 personnes pour 100 000 habitants, complique également le recrutement des patients pour les essais cliniques. Cependant, la recherche sur d'autres maladies à répétition de polyglutamine, en particulier la maladie de Huntington (MH), a fourni des indications précieuses sur les approches thérapeutiques pour les SCA polyQ. La recherche actuelle se concentre sur l'exploration de nouvelles stratégies thérapeutiques, en particulier au stade pré-ataxique, lorsque les traitements pourraient potentiellement retarder ou même prévenir l'apparition de symptômes plus graves. Ainsi, l'identification de biomarqueurs de neuro-imagerie sensibles capables de détecter les changements cérébraux avant que les symptômes cliniques ne se manifestent est essentielle pour un diagnostic précoce et pour l'évaluation de l'efficacité des traitements de fond dans les essais cliniques (Cui, 2024).
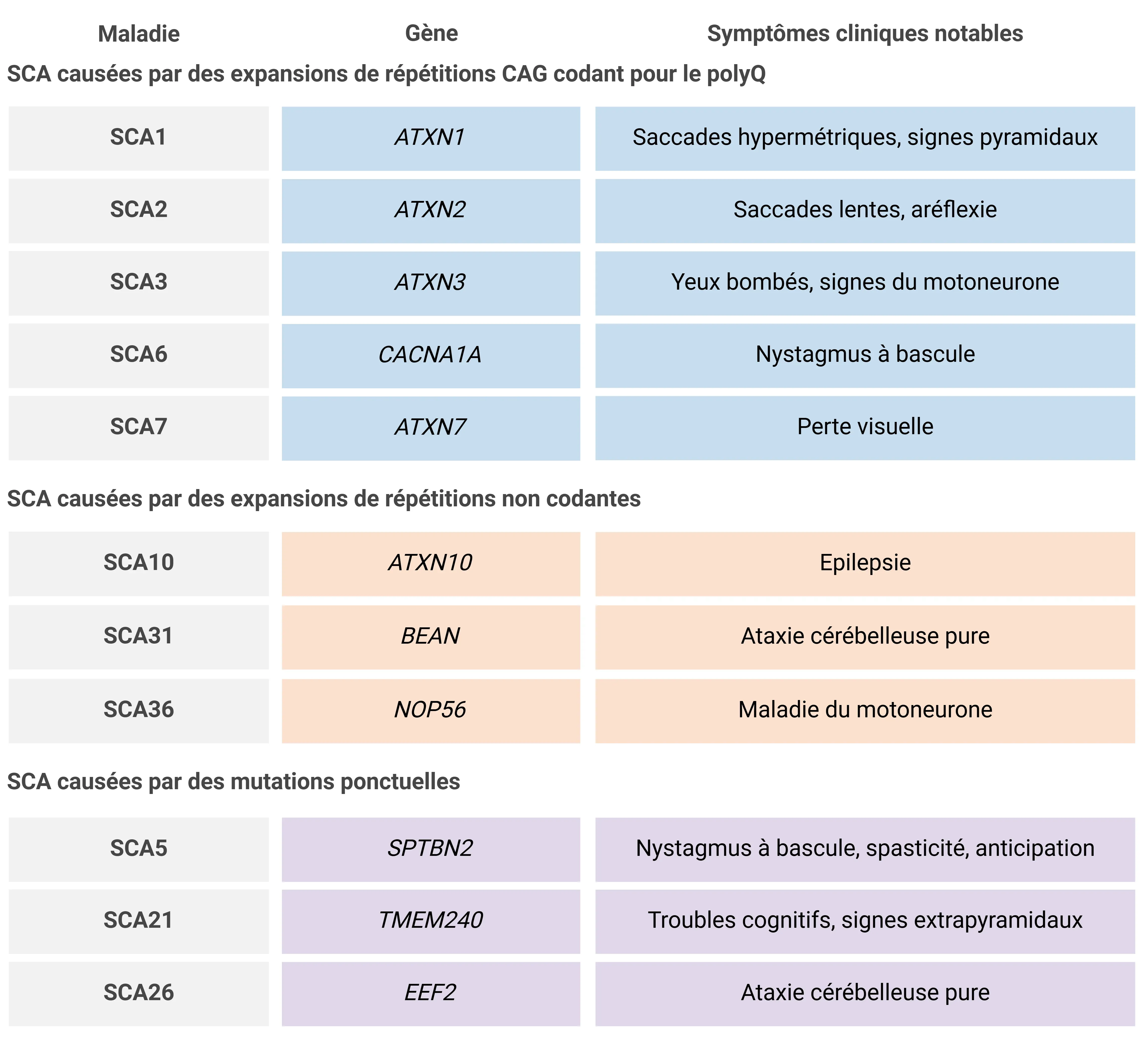
Tableau représentant une petite fraction des plus de 40 SCA connues, y compris un sous-ensemble de celles causées par des expansions de répétitions CAG codant pour le polyQ, des expansions de répétitions non codantes et des mutations ponctuelles, ainsi que leurs gènes associés et leurs symptômes cliniques notables. L'ataxie est le symptôme le plus courant, mais les manifestations cliniques varient d'un sous-type à l'autre. Adapté de Cui et al. (Cui, 2024) sous la licence Creative Commons Attribution License.
Quels sont les biomarqueurs de neuro-imagerie les plus efficaces pour suivre la progression de la SCA?
Imagerie par résonance magnétique (IRM) structurelle
L'IRM structurelle est un outil clé pour évaluer l'atteinte des régions cérébrales dans la SCA, révélant que l'étendue de l'atrophie du cervelet, de la moelle épinière et du tronc cérébral varie selon les sous-types de la SCA (Iwabuchi, 2022). Une étude comparant les stades précoces des SCA1, SCA2, SCA3 et SCA7 a révélé des réductions significatives des volumes du cervelet et du pons dans tous les groupes sur une période de 24 mois (Adanyeguh, 2018). L'analyse longitudinale a montré que les patients SCA présentaient des taux d'atrophie plus rapides dans ces régions par rapport aux témoins, à l'exception de SCA7, où le taux d'atrophie cérébelleuse ne différait pas significativement des témoins. Des différences de volume ont également été observées dans le pallidum, la moelle et le mésencéphale à la fois au début et à la fin de l'étude (Adanyeguh, 2018).
Les changements de volume chez les patients SCA pré-ataxiques, offrent des indications précieuses sur la progression des stades pré-ataxiques aux stades ataxiques. Dans le SCA2, les volumes du tronc cérébral, en particulier dans la région pontine, sont réduits à la fois chez les patients ataxiques et pré-ataxiques (Reetz, 2018). Dans le SCA17, une atrophie a été observée dans le cervelet et le noyau caudé chez les patients ataxiques et pré-ataxiques (Brockmann, 2012). Ces résultats pourraient permettre de distinguer les différents stades de la SCA et servir de biomarqueurs prometteurs pour le suivi de la progression de la maladie.
Dans les stades ataxiques et pré-ataxiques précoces de la SCA3, les études rapportent des résultats différents. Faber et al. (Faber, 2021) ont constaté que la perte de volume du cervelet était moins prononcée que celle de la moelle épinière et du tronc cérébral, avec un déclin régulier du volume du pons, qui était le plus important au début de l'ataxie. En revanche, Rezende et al. (Rezende, 2024) ont observé des changements significatifs dans le volume cérébelleux droit, avec des tailles d'effet élevées même à des stades précoces, mais aucun changement dans le volume du pons. Ces résultats contrastés en neuro-imagerie peuvent refléter la variabilité de la progression de la maladie SCA3 et de la gravité des symptômes, soulignant l'importance d'une stratification correcte des patients dans les essais cliniques.
Imagerie du tenseur de diffusion (DTI)
Les anomalies de la matière blanche détectées par DTI accompagnent les changements structurels observés dans le SCA. Dans les stades précoces des SCA1, SCA2 et SCA3, une diminution de l'anisotropie fractionnelle (AF) et une augmentation de la diffusivité radiale (DR) sont observées dans plusieurs voies par rapport aux témoins (Adanyeguh, 2018). Ces changements sont plus prononcés dans les pédoncules cérébelleux et cérébraux, ainsi que dans les voies transversales pontines. Des anomalies dans le tractus corticospinal, la corona radiata et la capsule interne sont également observées dans les SCA1 et SCA2, le SCA2 présentant une réduction de l'AF dans le corps calleux (Adanyeguh, 2018). En revanche, une DR élevée, mais aucun changement dans l'AF, est observée dans le SCA7, tandis qu'aucun changement dans le corps calleux, la capsule interne ou la couronne radiata n'est observé dans le SCA3 (Adanyeguh, 2018). Cependant, d'autres études ont signalé une réduction de l'AF et une augmentation de la DR dans les stades précoces du SCA3, en particulier dans la corona radiata droite et le fascicule longitudinal supérieur droit, mettant en évidence des résultats opposés pour le SCA3 dans la corona radiata (Rezende, 2024). Ces résultats opposés pour le SCA3 dans la corona radiata peuvent être attribués à des différences dans les populations de patients ou les stades de la maladie, ce qui indique la nécessité d'une étude plus approfondie de ces résultats contradictoires.
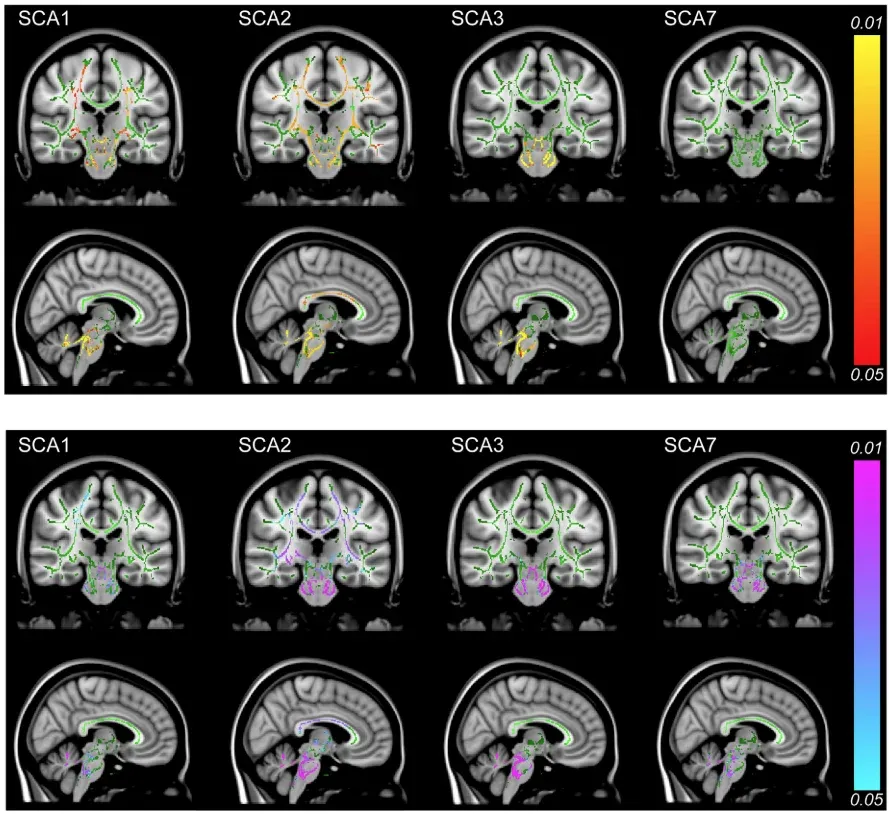
La DTI montre une AF plus faible dans les SCA1, SCA2 et SCA3 (panneau supérieur) et une DR plus élevé dans tous les groupes (panneau inférieur). Les changements sont les plus prononcés dans le cervelet, les pédoncules cérébraux et les voies pontines, avec une implication supplémentaire du tractus corticospinal, de la corona radiata, de la capsule interne (SCA1, SCA2) et du corps calleux (SCA2). Les zones rouge-jaune indiquent une diminution de l'AF et les régions bleu-rose une augmentation de la DR. Figure reproduite d'après Adanyeguh et al. (Adanyeguh, 2018) sous la licence Creative Commons Attribution License.
Spectroscopie par résonance magnétique (MRS)
La MRS est un outil sensible pour détecter les changements neurochimiques, même dans les SCA pré-ataxiques, ce qui la rend utile pour suivre la progression de la maladie (Brooker, 2021; Chen, 2021). Dans les stades précoces à modérés des SCA1 et SCA2, le N-acétylaspartate total (tNAA) et le glutamate sont réduits dans le cervelet et le pons par rapport aux témoins, tandis que le myo-inositol et la créatine totale (tCr) sont élevés (Öz, 2010; 2011). Dans le SCA1, le rapport tNAA/myo-inositol dans le cervelet et les osselets diffère de celui des témoins avec une sensibilité et une spécificité élevées (Öz, 2010). Des réductions des rapports NAA/Cr et NAA/choline dans le cervelet sont observées dans les SCA1, SCA2, SCA3, SCA6 et SCA17 (Chen, 2021). Cependant, le SCA6 présente moins d'altérations neurochimiques que les témoins, avec une implication moindre du pons et un rapport NAA/Cr cérébelleux plus élevé que dans le SCA1 et le SCA2 (Öz, 2011). Ces résultats soulignent que la MRS est un outil prometteur pour détecter les changements neurochimiques dans la SCA. En outre, la MRS joue un rôle crucial dans la différenciation des divers sous-types de SCA et leur distinction par rapport aux témoins, aidant ainsi à la stratification des patients et servant de biomarqueur précieux dans les essais cliniques.
Corrélations cliniques
Les résultats de la neuro-imagerie sont en corrélation avec les mesures cliniques, ce qui permet de mieux comprendre l'évolution de la maladie et le devenir des patients. La réduction du volume cérébelleux est étroitement corrélée à la sévérité de l'ataxie, telle que mesurée par l'analyse basée sur la région d'intérêt (ROI) et la morphométrie basée sur le voxel (VBM) dans les SCA1, SCA2, SCA6 et SCA17 (Chen, 2021). Le score SARA est en corrélation avec les volumes du cervelet, du tronc cérébral, du caudé, de la moelle épinière, de la substance blanche cérébelleuse, ainsi qu'avec les métriques DTI sur plusieurs voies (Adanyeguh, 2018; Chen, 2021). Il est important de noter que les scores cliniques présentent des tailles d'effet longitudinal plus petites que les tailles d'effet importantes observées avec les changements volumétriques, ce qui suggère que les biomarqueurs IRM peuvent fournir des mesures plus sensibles de la progression de la maladie, ce qui en fait des outils précieux pour les essais cliniques (Adanyeguh, 2018; Faber, 2021).
En outre, il a été démontré que les résultats de la MRS étaient en corrélation avec les résultats cliniques. Dans le SCA1, les niveaux de tNAA, de myo-inositol et de glutamate dans le cervelet, et de tNAA et de myo-inositol dans le pons, sont en corrélation avec le score SARA (Öz, 2010). Le rapport NAA/Cr dans le vermis cérébelleux est en corrélation avec le score SARA dans les SCA2 et SCA3, tandis que le rapport NAA/Cr dans l'hémisphère cérébelleux droit présente une corrélation plus forte avec le score SARA dans le SCA6 (Wang, 2012). Ces résultats soulignent que les différentes mesures de la MRS sont en corrélation avec les scores cliniques de manière distincte dans les sous-types de SCA, ce qui permet de comprendre comment les changements neurochimiques peuvent refléter la progression de la maladie dans chaque sous-type. Étant donné la nature complexe de la SCA, une approche multimodale des biomarqueurs est recommandée pour améliorer la précision et l'utilité du suivi de la progression de la maladie (Adanyeguh, 2018; Chen, 2021).
Quelles sont les approches thérapeutiques actuellement étudiées dans le cadre d'essais cliniques pour la SCA?
Il n'existe actuellement aucun traitement de fond pour la SCA, mais plusieurs approches visant à ralentir la progression de la maladie sont à l'étude. La rareté des SCA, leur gravité et leur progression variables, ainsi que leur hétérogénéité clinique et génétique, constituent les principaux défis à relever pour mener des essais cliniques. Pour faire face à ces difficultés, les chercheurs explorent diverses stratégies thérapeutiques, notamment les technologies des cellules souches, l'interférence ARN (ARNi), les oligonucléotides antisens (ASO), les approches basées sur CRISPR, les modulateurs de l'autophagie et les interventions pharmacologiques, entre autres (Kwei, 2020; Brooker, 2021; Ghanekar, 2022; Correia, 2023).
Les essais cliniques en cours portent sur Stemchymal®, une technologie de cellules souches conçue pour ralentir la progression de la maladie (NCT06397274, NCT03378414), les modulateurs du glutamate tels que le troriluzole (NCT06529146, NCT03701399) et les thérapies ARNi telles que ARO-ATXN2 (NCT06672445). Les ASO, dont VO659, sont également à l'étude pour la SCA et la MH (NCT05822908). En outre, plusieurs études sur l'histoire naturelle de divers sous-types de SCA sont actuellement en cours et pourraient fournir des informations précieuses sur la progression de la maladie et contribuer au développement de thérapies ciblées (NCT02741440, NCT02440763, NCT01060371, NCT06472557). Les biomarqueurs de neuro-imagerie sont également évalués dans le cadre d'essais cliniques et pourraient jouer un rôle crucial en offrant des mesures objectives de la gravité de la maladie, en surveillant la réponse au traitement et en améliorant la conception des futures interventions thérapeutiques (NCT05160883, NCT04297891).
Compte tenu de la pathogenèse commune aux SCA, il a été proposé que des traitements de fond soient développés pour de multiples sous-types (Cui, 2024). Cependant, les protéines sous-jacentes distinctes pour chaque sous-type de SCA représentent un défi pour cette approche, suggérant que des traitements personnalisés adaptés aux causes génétiques des SCA individuels pourraient être nécessaires (Cui, 2024).
Lors de la conception d'essais cliniques, plusieurs facteurs doivent être pris en compte, tels que l'âge d'apparition, la longueur des répétitions et l'âge au moment de l'inclusion dans l'essai, car ces facteurs sont importants pour la stratification des patients et la prédiction de la gravité de la maladie. Pour les SCA polyQ, la longueur des répétitions CAG est un déterminant essentiel de la gravité de la maladie (Brooker, 2021). Un recrutement efficace pour les essais nécessite également une collaboration et la mise en place de registres de patients. Aux États-Unis, le Clinical Research Consortium for Spinocerebellar Ataxias (CRC-SCA) joue un rôle central dans l'avancement de la recherche, tandis que des initiatives mondiales comme SCA Global visent à accélérer la découverte de biomarqueurs et le développement de traitements en normalisant les méthodes de recherche et en étendant les efforts à l'échelle internationale (Brooker, 2021).
Notre équipe se fera un plaisir de répondre à vos questions sur les essais cliniques et les biomarqueurs d'imagerie de l'ataxie spinocérébelleuse ou de vous fournir des informations spécifiques sur nos autres services d'imagerie.
Découvrez nos services d'imagerie
Contenu connexe
Informations actualisées sur les meilleures pratiques liées à l'utilisation de la neuroimagerie dans les essais cliniques sur les maladies neurologiques.
Biomarqueurs d'imagerie pour les essais cliniques sur l'ataxie de Friedreich
Un aperçu de l'utilisation des biomarqueurs d'imagerie IRM et DTI pour l'ataxie de Friedreich (FRDA) dans les études de recherche et les essais cliniques multicentriques.
Biomarqueurs IRM dans les essais cliniques de la maladie de Huntington
Un aperçu de l'utilisation des biomarqueurs d'imagerie IRM structurelle et de diffusion pour les essais cliniques de la maladie de Huntington (MH).
Biomarqueurs TEP dans les essais cliniques sur la maladie de Huntington
Un aperçu de l'utilisation des biomarqueurs d'imagerie TEP pour les essais cliniques de la maladie de Huntington (MH).
L'IRM dans les essais cliniques sur l'atrophie du système multiple (MSA)
Cette ressource donne un aperçu de l'utilité de l'IRM volumétrique et de l'imagerie pondérée en diffusion (DWI) en tant que biomarqueurs dans les études de recherche sur la MSA.