为什么在TSC的临床试验中使用神经影像学?
结节性硬化症(TSC)是一种多系统遗传性疾病,其特征是脑、皮肤、心脏、肺和肾脏出现肿瘤,由TSC1和TSC2肿瘤抑制基因的功能丧失突变引起。这种疾病在全球范围内影响多达200万人,每6000到10000名新生儿中就有1例,其中三分之二的病例带有新突变(Henske,2016 )。
TSC是一种终身性疾病,在子宫内就开始显现,90-95%的病例涉及中枢神经系统(CNS)(Curatolo,2015 ;Russo,2020 )。最早的表现是中枢神经系统出现脑膜下结节(SEN)和胎儿大脑皮层结节(Russo,2020 )。随着时间的推移,脑膜下结节可能会演变为脑膜下巨细胞星形细胞瘤(SEGA),并可能以危及生命的方式阻塞大脑的脑室系统。此外,还会出现白质病变,从结节扩展到皮质下白质。
这些解剖学上的变化反过来又会导致一系列与TSC相关的神经精神疾病(TAND),主要包括癫痫、自闭症谱系障碍(ASD)、智力障碍以及注意力缺陷多动障碍(ADHD)、焦虑和抑郁障碍。癫痫通常在出生后的第一年开始,三分之二病例在医学上难以治愈(即难以治疗或无法治疗)(Henske,2016 ),而自闭症则在5岁前出现(Peters,2013 )。许多认知方面的问题都会受到影响,从早期的行为层面(攻击性、焦虑、多动、注意力不集中)开始,随后是智力和学术方面的困难,以及终生的心理社会(自尊、父母压力、人际关系困难)和神经心理(双任务、注意力转换、记忆)障碍(Curatolo,2015 )。
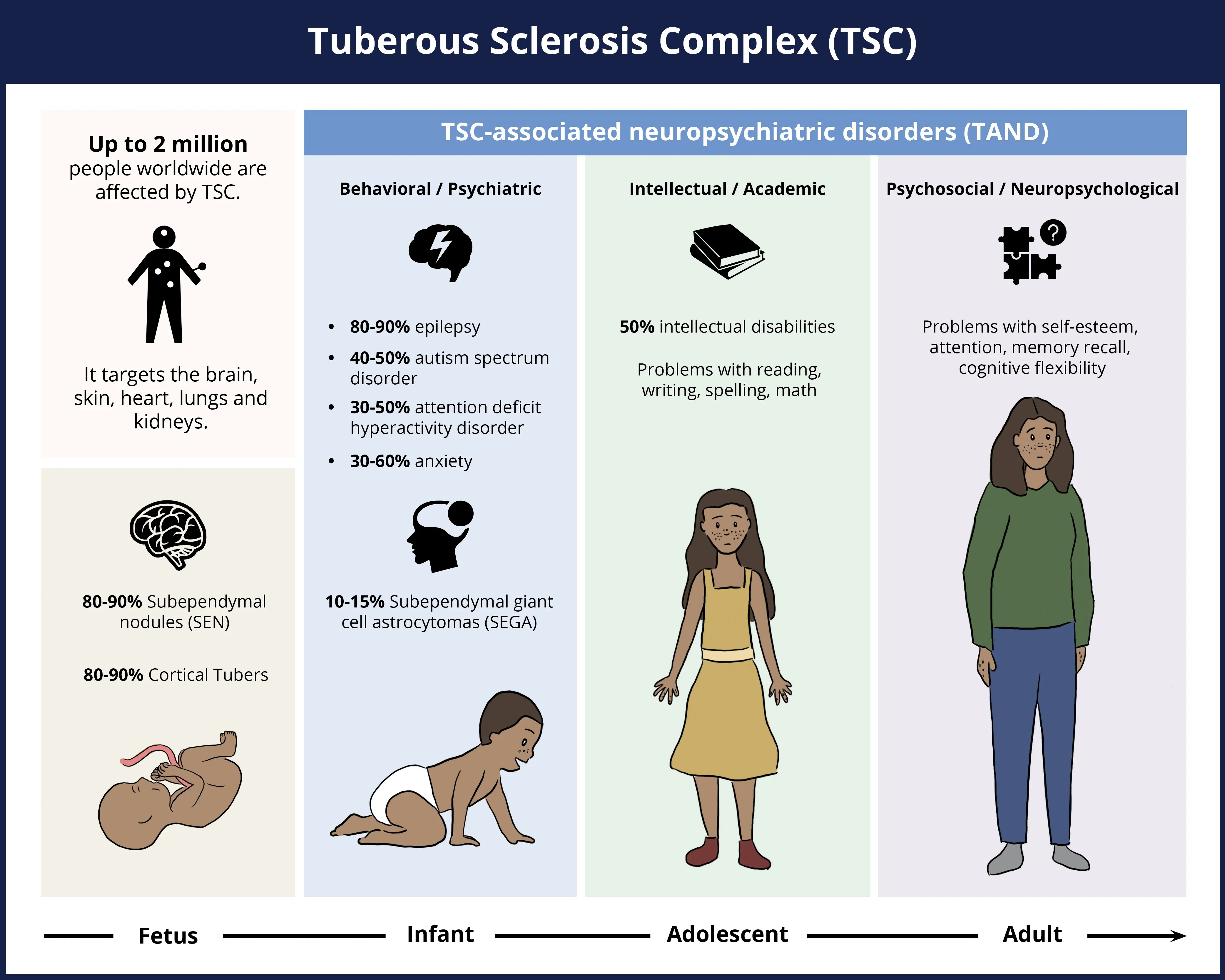
结节性硬化症(TSC)是一种多系统疾病,通常在胎儿发育期间就出现症状,从出生到成年,神经系统疾病负担一直很重,但皮肤、心脏、肺和肾脏也会受到影响。上图显示了各种神经系统特征或症状的发生率。
虽然许多器官都会受到疾病的影响,但神经系统症状被认为是导致发病最常见的原因,也是导致死亡的最常见原因之一(Russo,2020 ),也是本资源关注的重点。因此,神经影像学不仅对诊断,而且对监测和管理疾病都至关重要。特别是磁共振成像(MRI)被公认为识别和确认神经系统受累以及追踪TSC患者随时间变化情况的参考方法。
哪些核磁共振成像生物标记可用于评估TSC的纵向变化?
皮质结节的数量和体积:否
TSC以皮质结节命名,在死后检查中首次被描述为厚实而坚固的脑回(Henske,2016 )。它们是神经胶质非癌性肿块,大脑皮质的6层组织结构紊乱,有时从皮质脑回延伸到皮质下白质(Russo,2020 )。它们被认为是TSC癫痫发作的主要原因,其数量和空间分布与症状严重程度有关。它们虽然可以在大脑皮层的任何地方找到,但通常存在于额叶和顶叶,也可能位于脑下(Martí-Bonmatí,2000 )。
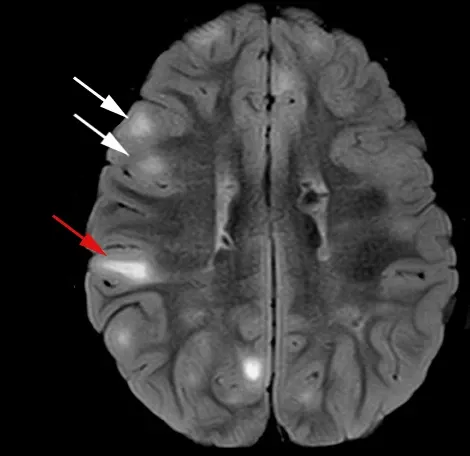
皮质结节(白色箭头)和放射状迁移线(红色箭头)的示例,在T2加权成像中可见,伴有液体衰减(FLAIR)。图片根据“知识共享署名许可协议”改编自Cohen等人(Cohen,2021 )的作品。
在核磁共振成像(MRI)中,通常使用T1加权(T1W)和T2加权成像(T2W)进行研究,有时也会使用流体衰减(FLAIR)。对比度取决于大脑发育状态,在婴儿中,T1W上首先出现高信号,T2W上出现低信号(Russo,2020 )。髓鞘成熟后,对比度会反转,结节在T2W上主要表现为高信号,这与随年龄增长和神经退行性疾病中观察到的白质病变非常相似。在所有情况下,受影响的回都会出现增厚,灰质和白质之间的鲜明对比消失,取而代之的是信号强度梯度。
已描述了许多不同类型的块茎(Gallagher,2010 ;El-Beheiry,2018 ):
- A型:在T2W上呈高信号,在T1W上呈等信号
- B型:T2W上高信号,T1W上低信号
- C型:T2W上呈高信号,T1W上呈低信号,FLAIR上呈异质性,低信号核心信号被高信号边缘(“囊状”)包围
- D型:与C型类似,在磁共振波谱成像(SWI)中呈弥漫状
研究发现,随着后几种类型结节的数量和体积增加,疾病及相关神经系统疾病的严重程度也会增加。例如,较大的结节通常与癫痫发作次数增加有关。虽然据称在胎儿发育后,结节的大小会保持稳定(Russo,2020 ),但纵向研究观察到,有一半患者的结节会随着时间的推移而发生变化(Vaughn,2013 ;Daghistani,2015 )。一项案例研究显示,囊肿样病变(上文称为C型)的数量和大小确实可能增加(Chu‐Shore,2009 )。结节可能由于对比度变化而显得是新出现的,也可能与正常大脑发育成比例地增长(Russo,2020 )。它们也可能由于钙化而随着时间的推移而发生变化(Vaughn,2013 )。由于没有广泛证据表明结节的数量或体积会随时间推移而变化(与正常发育成比例除外),或由于治疗而发生变化(除非新的皮质组织生长),因此其数量和体积可能不是追踪纵向变化的重要生物标记,但仍然是代表疾病神经表现严重程度的重要成像生物标记。
SEN(脑室下结节)数量:无
SEN是直径小于1厘米的良性组织增生,发生在脑室系统的脑膜衬里中。它们通常钙化(Russo,2020 ),因此很容易在计算机断层扫描(CT)和磁共振成像(MRI)中检测到,例如T2*加权成像。它们在T1W和有时在T2W上也会出现高信号。它们的数量往往很多,一般位于尾状核和丘脑附近,但也可能出现在第三和第四脑室附近。
与皮质结节类似,SEN的数量在胎儿发育期后通常保持稳定,仅出现与钙化相关的变化(Curatolo,2015 ),因此可能无法作为纵向生物标记。然而,人们认为它们可能会长成SEGA,因此对其进行监测非常重要,下文将对此进行说明。
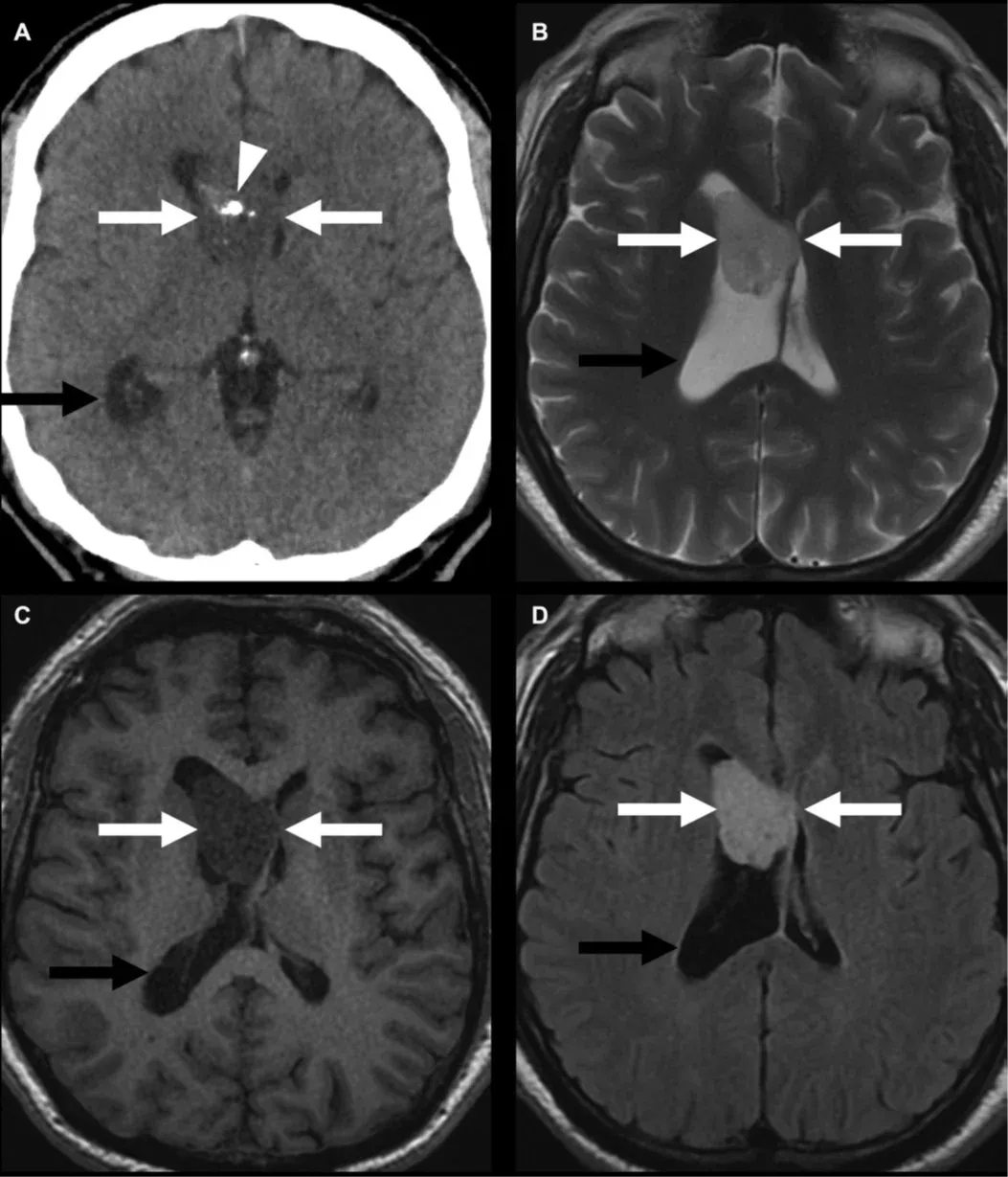
WHO 1级小脑幕下肿瘤(白色箭头)的示例,类似于小脑幕下巨细胞星形细胞瘤(SEGA),在患有TSC的个体中观察到,如计算机断层扫描(A)所示,钙化(箭头)、T2W(B)、T1W(C)和对比增强后(D)。如果未能及早发现,它们会导致阻塞性脑积水(黑箭头),因为蒙罗孔被堵塞。图片根据《创作共用许可协议》转载自Mu等人(Mu,2023 )。
SEGA(室管膜下巨细胞星形细胞瘤)的数量和体积:是的
SEGA是WHO 1级良性神经胶质瘤,TSC患者中10-15%会出现这种肿瘤,一般认为是由SEN引起的(Northrup,2013 ;Roth,2013 ;Henske,2016 )。虽然它们通常生长缓慢,但如果不加以监控,它们可能会危及生命,因为它们会导致心室系统阻塞(阻塞性脑积水)。它们几乎只出现在靠近蒙罗孔的尾状丘脑沟,因此,在其他位置出现的SEN通常是安全的,尽管有报告称存在非典型的SEGA位置(Russo,2020 )。根据2012年共识指南(Roth,2013 ),护理标准规定,通常每1-3年进行一次常规神经影像检查,以监测SEGA的发展,直到25岁。之所以选择25岁为截止年龄,是因为新出现的SEG在25岁以后很少出现,但已有的SEG可能会继续增大,后续扫描的频率应根据现有病灶的稳定性进行调整。
在核磁共振成像(MRI)中,SEGA是轮廓分明的肿块,几乎完全包含在心室系统内,但可能会有例外(Roth,2013 )。它们的T1W和T2W对比度与脑实质组织相似,但外观不均匀(Russo,2020 )。它们显示出强烈的对比度增强,但建议不要重复使用造影剂。由于SEGA的性质不断增长,它们的数量和体积都是TSC纵向变化的相关生物标志物。
白质异常:是
几乎所有TSC患者都存在白质病变,从放射状迁移线(RML)到更细微的弥漫性白质异常(Curatolo,2015 ;Russo,2020 )。人们越来越认识到,前面提到的宏观影像特征并不能解释所有TAND表现,白质异常可能与部分神经系统症状有关。
RMLs是核磁共振检查中可见的线条,从脑室周围区域辐射到皮质下白质,有时连接到皮质结节或突然终止于白质,被认为是神经元迁移受损的结果(Russo,2020 )。与皮质结节类似,它们首先在婴儿的T1W上表现为轻度高信号,然后在髓鞘化后的T2W上表现为高信号。利用先进的核磁共振成像技术(如功能核磁共振成像和扩散核磁共振成像)对更细微的白质异常进行了研究,发现正常白质存在广泛变化(Russo,2020 )。这些变化会逐渐发展,直到5岁,与神经精神疾病同时发生,因此,在可能的关键干预窗口期,这些变化可能是有用的纵向生物标记(Peters,2015 )。这些白质变化最好通过扩散磁共振成像进行测量,我们将在下一节中对此进行进一步描述。
扩散加权成像(DWI)在TSC研究中是否可用作生物标记?
扩散加权成像(DWI)或扩散磁共振成像(DWI)通常用于研究脑实质微结构的改变。它通常用于白质,因为髓磷脂是一种脂质,它降低了髓磷脂鞘的扩散方向,因此可以捕捉髓磷脂的差异和变化以及白质纤维的完整性。虽然临床环境中通常使用表观扩散系数(ADC)图,但临床试验和研究环境中通常使用扩散张量成像(DTI)模型(Le Bihan,2001 ),因为它能够通过其拟合指标很好地捕捉这些方向效应,特别是分数各向异性(FA),以及轴向和径向扩散率(相对于最高扩散率的方向,通常是白质纤维束的方向)。值得注意的是,较高的FA通常表示白质更健康,因为它反映了更紧密、更髓鞘化、更有组织和更连贯的白质,而较高的平均扩散率(MD)通常反映的是更易漏损、受损、边界不连贯且可能存在星形胶质细胞增生症的白质。目前存在更先进的扩散磁共振成像模型,例如神经元取向弥散和密度成像(NODDI)模型(Zhang,2012 ),但它们通常需要更先进的采集方案,这在多中心临床试验中可能具有挑战性。
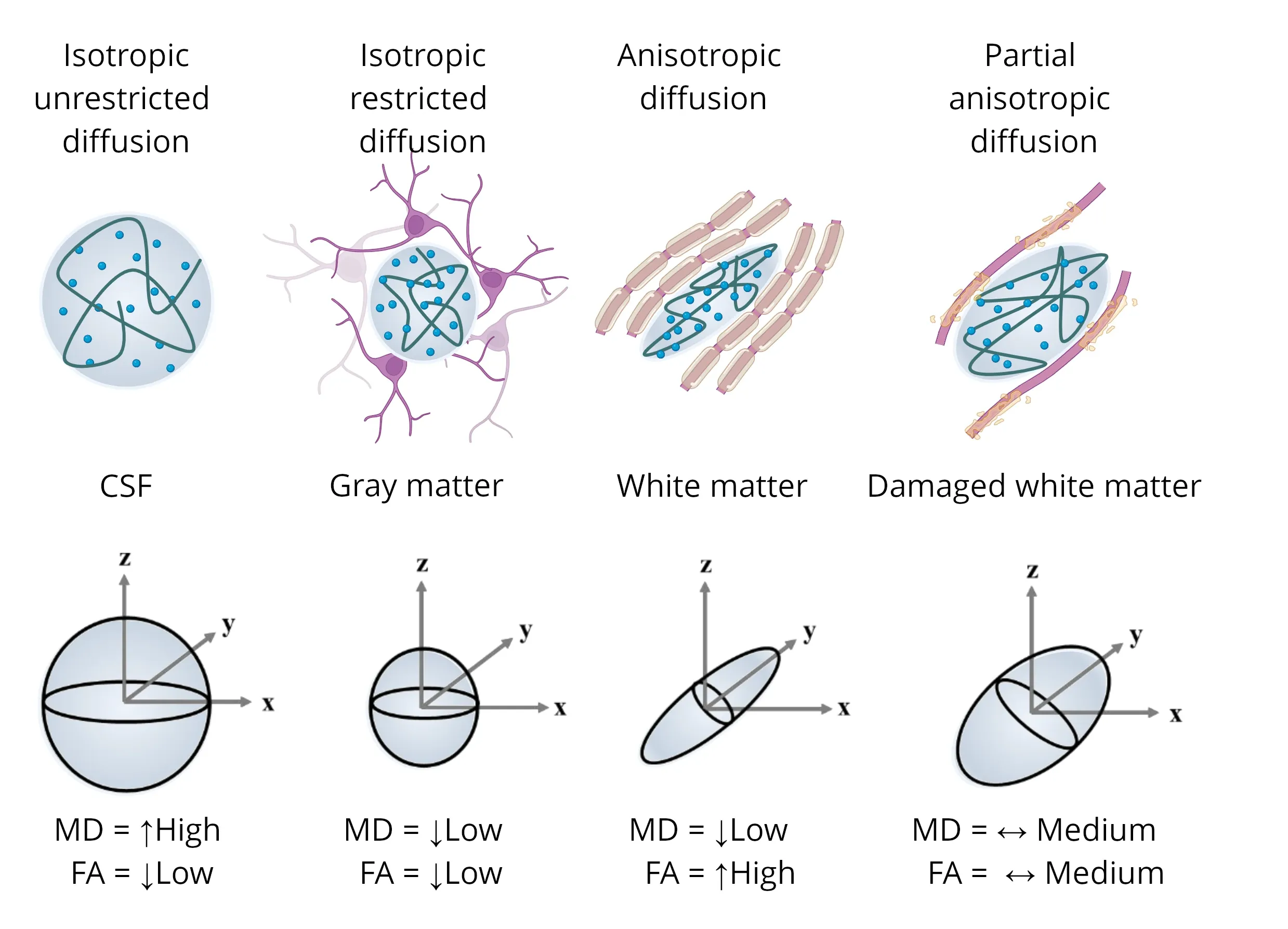
不同微观结构下的扩散张量示意图,突出了各向异性水成分(以椭圆蓝点表示)对最终张量的影响。每种情况都包括平均扩散率(MD)和分向异性(FA)的表示。该图改编自Colman等人(Colman,2022 ) 的《知识共享署名许可协议》。
DTI研究表明,TSC患者皮质结节周围受影响的区域比常规MRI检查可见的区域更大(Peters,2013 )。结节周围的区域似乎形成了一个梯度,从结节内最低的FA和最高的MD到TSC患者正常外观白质(NAWM)中与对照组白质相当的值(Peters,2015 )。经卢索尔快速蓝染色评估,球茎周围区域DTI指标的梯度与髓磷脂的组织病理学密切相关(Peters,2019)。与NAWM相比,结节中的低FA和高MD与它们已知的无序细胞组织和结构一致,并且与NAWM的差异也随着结节类型/严重程度的增加而增加,在C型结节中最明显(Gallagher,2010 ;El-Beheiry,2018 )。在5岁之前,这三个区域(结节、结节周围、NAWM)的FA均显著增加,MD均显著降低,之后观察到变化速度变慢,与健康儿童白质的成熟变化相似(Peters,2015 )。结节和结节周围区域的FA和MD从未达到正常水平,这可能为干预结节周围区域提供了潜在机会。
即使未达到结节或结节周围区域的水平,在TSC患者的NAWM中也发现了DTI指标的异常。此外,与年龄相当的对照组相比,他们胼胝体及其突起的FA值明显更低,平均扩散率和径向扩散率更高,DTI测量值也与结节体积相关(Makki,2007 ;Simao,2010 ;Peters,2012 )。特别是,患有TSC并伴有自闭症谱系障碍(ASD)的个体,其FA值明显低于其他患有TSC的个体(Peters,2012 )。后来的研究也发现了类似的结果,并进一步指出,TSC与ASD、智力障碍和癫痫同时发生,似乎以叠加的方式与胼胝体FA值降低相关(Baumer,2018 )。TACERN研究小组的另一项研究发现,与患有TSC但未患ASD的患者相比,患有TSC和ASD的患者在多个白质区域中FA的纵向增加随着时间的推移而减少(Prohl,2019 ),尽管同一小组后来的纵向研究未能显示显著差异(Srivastava,2024 )。这些研究表明,DTI可能作为临床试验中的生物标记物是有用的,因为它与儿童时期出现的神经系统负担和相关神经精神疾病有关。
DTI指标还能够显著检测接受依维莫司治疗的TSC患者的纵向变化,依维莫司是一种经FDA批准的用于治疗SEGA和难治性癫痫的辅助治疗药物(Tillema,2012 )。在治疗12-18个月后,观察到胼胝体和其他感兴趣区域的FA增加,MD减少,而对照组则没有相应变化。同样,在一项独立研究中,治疗组胼胝体的MD值也出现了下降,而对照组则保持不变(Peters,2019)。此外,随着治疗时间的延长,MD值下降幅度增大,FA值上升,在年轻亚组(10岁以下)中尤为明显,这与一项独立试验中观察到的癫痫发作频率降低的情况非常相似(Franz,2021 )。由于致痫结节中的MD值更高且FA值更低(Peters,2013 ),且在相同治疗条件下,尤其是持续时间较长且年龄较小时,DTI指标和发作频率均得到改善,因此该数据为DTI指标作为有效的纵向成像生物标志物提供了证据,尤其是对于早期干预,且它们可能在临床试验中对治疗产生反应。
我们的团队将很乐意回答有关结节性硬化症神经影像生物标记的任何问题,或提供有关其他影像服务的具体信息。
相关内容
神经影像学在神经疾病临床试验中的最佳实践的最新信息。
亨廷顿病临床试验中的正电子发射断层成像
PET成像生物标记在亨廷顿病(HD)临床试验中的应用概述。
多发性硬化症临床试验中的MRI加碘病变
在多发性硬化症(MS)临床试验中,如何利用钆(Gd)增强病变来追踪疾病进展和治疗干预反应。
弗里德雷希运动失调症临床试验的影像生物标记
MRI和DTI成像生物标记在弗里德雷希特共济失调症(FRDA)研究及多中心临床试验中的应用概述。