この資料では、以下の内容について説明しています。
CBDとは何ですか?また、PSPや他のタウオパチーとはどのように異なるのですか?
タウオパチーの紹介
タウオパチーは、脳内のタウタンパク質の異常凝集を特徴とする神経変性疾患群です。タウタンパク質は、微小管結合タンパク質(MAPT)遺伝子によってコードされる主要な神経微小管結合タンパク質(MAP)であり、微小管の形成と安定化を促進します(Spillantini, 2013)。複数の疾患がこの異常タウという重要な特徴を共有していますが、タウの蓄積のしかた、影響を受ける脳の領域、臨床症状はそれぞれ異なります(Parmera, 2022)。タウオパチーは、タウ病理によって、一般的に以下の図に示されるように3つの主要なグループに分類されます(Ganguly, 2020年より)。本リソースでは、主に大脳皮質基底核変性症(CBD)に焦点を当て、進行性核上性麻痺(PSP)などの他のタウオパチーとの比較を行います。
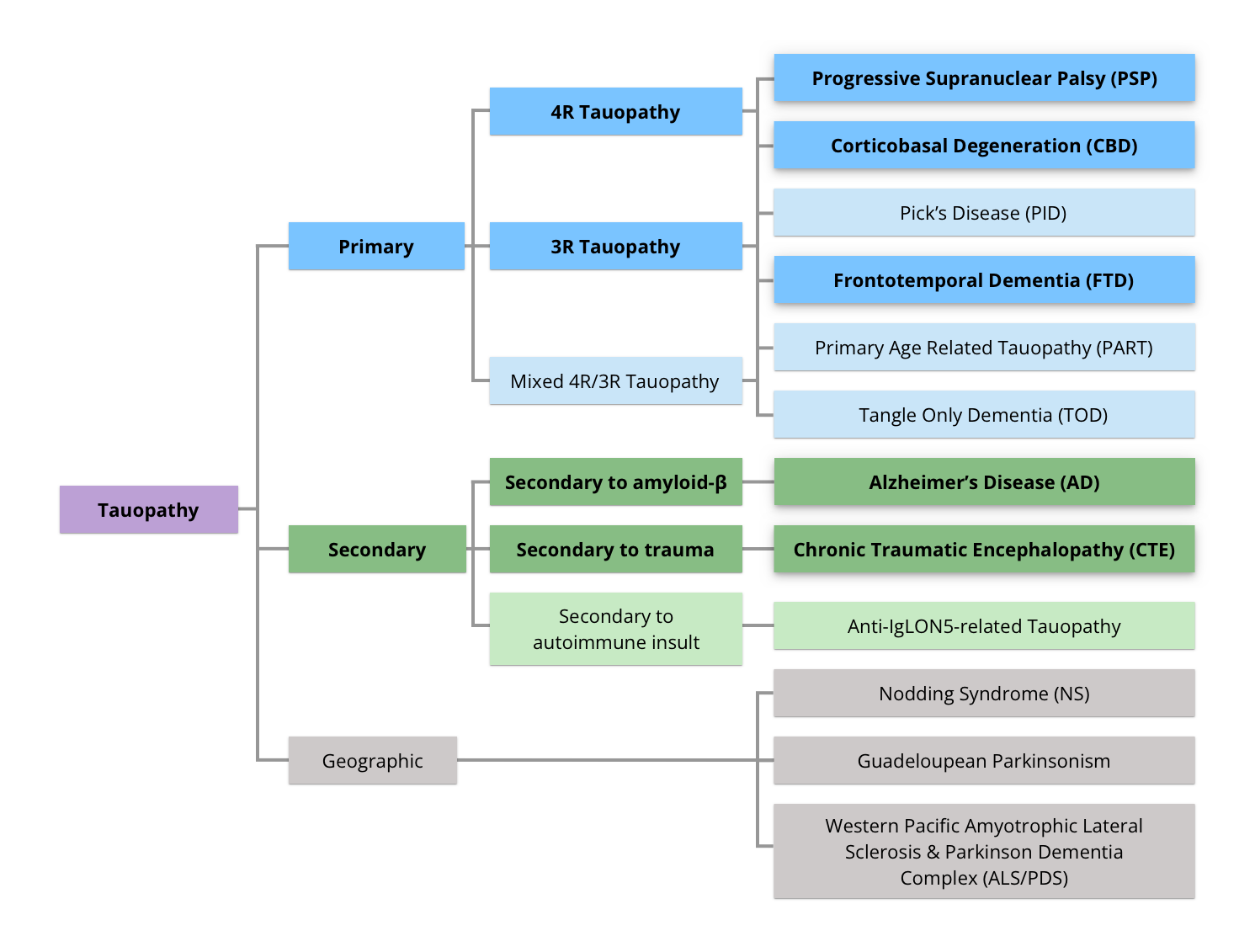
タウオパチーの階層的分類は、一次、二次、地理的カテゴリーに分けられます(図 はGanguly, 2020より作成 、クリエイティブ・コモンズ表示ライセンス)。
CBDの臨床的特徴と診断
CBDはまれな疾患で、通常は60歳代で発症し、平均発症年齢は63.5歳で、45歳から77歳までの範囲です(Wenning, 1998;Josephs, 2006; Ling, 2010)。男性と女性に等しく発症し、非対称性の運動障害(例: こわばり、 動作緩慢、ミオクローヌス)や、失語症、記憶喪失、実行機能障害などの認知障害を伴うことがよくあります。 その他の症状にはジストニア、失行、異所性肢症候群などがあります(Grijalvo-Perez, 2014)。 臨床的にPSPやパーキンソン病(PD)など他の疾患と症状が重なること、また特定の生前の診断マーカーがないことから、CBDの診断は依然として困難です(Litvan, 1997)。
CBDとPSPで影響を受ける脳の領域
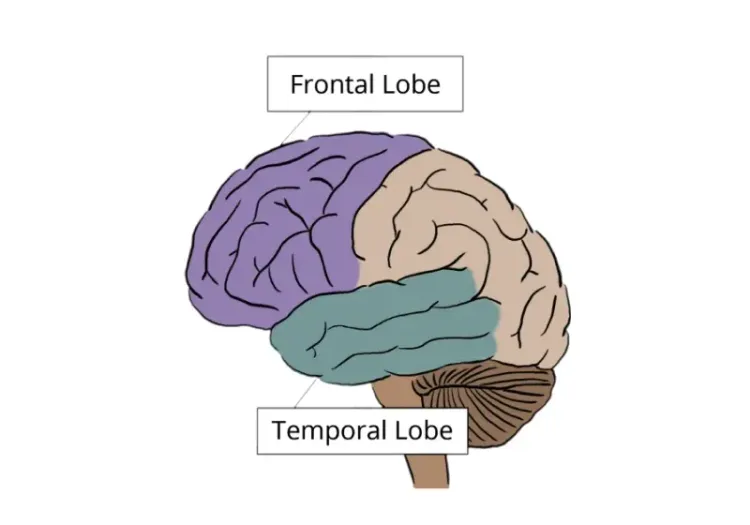
CBDとPSPの病理学的な違いは、主に脳内のタウタンパク質の分布に反映されています。PSPでは後脳の病理が多く見られますが、CBDでは大脳皮質の病理がより広範囲にわたって見られます(Dickson, 2002)。 PS Pは主に脳幹に影響を与え、姿勢の不安定、垂直性眼球運動麻痺、頸部硬直などの症状を引き起こします。一方、CBDは一般的に大脳皮質や大脳基底核に影響を与え、観念運動の失行や異所性肢現象などの運動や認知の非対称性がより顕著に現れます(Armstrong, 2013)。
細胞および分子レベルでの違い:CBDとPSPにおけるタウ病理
細胞レベルでは、CBDとPSPの両方において、特に4回繰り返し(4R)タウアイソフォームの異常な高リン酸化タウタンパク質の沈着が特徴的です(Constantinides, 2019)。両疾患において、高リン酸化タウは微小管に対する親和性を失い、微小管の機能不全と凝集傾向を引き起こします(Kouri, 2011)。脳抽出物の 免疫 ブロット法では、CBDとPSPで異なるタウ断片が示され、その表現型の違いに寄与する異なるタンパク分解経路が示唆されています(Arai, 2004)。
かつてはCBDの典型的な症状と考えられていた膨化または無色素のニューロンは、大脳皮質灰白質でより多く見られ、大脳基底核ではあまり見られません(Rebeiz, 1967)。しかし、最近の研究では、アストロサイトのプラークがCBDの特徴であることが確認され、房状アストロサイトはPSPの特徴であることが確認されています(Ferrer, 2014;Murray, 2014)。 さらに 、コイル状体(乏突起膠細胞におけるタウの沈着)は、これらの疾患の間で超微細構造的に異なります(Arima, 1997;Wakabayashi, 1994)。
他のタウオパチーとの比較:FTD、AD、CTE
CBDとPSPはそれぞれ独立した原発性タウオパチーですが、前頭側頭型認知症(FTD)、アルツハイマー病(AD)、慢性外傷性脳症(CTE)などの他のタウオパチーと類似点があります。 FT Dは一般的に早期発症の認知症として現れ、運動機能よりも行動や言語に影響を及ぼします。これに対し、CBDは運動機能や認知機能の障害がより顕著です。FTDの病理は、主に前頭葉と側頭葉に影響を及ぼすタウ、TDP-43、および/またはFUSタンパク質が関与しています(Mackenzie, 2010)。
最も一般的なタウオパチーであるアルツハイマー病(AD)は、進行性の記憶喪失と認知機能の低下が特徴です。タウ病理が中心となるCBDとは異なり、ADでは海馬、大脳皮質、およびその他の脳領域においてアミロイドβプラークと神経原線維変化の両方が見られます(Jack, 2013)。反復性の頭部外傷と関連することが多いCT E は、CBDやFTDと同様の運動および認知症状を引き起こすことがあります。しかし、CTEにおけるタウの沈着は主に皮質溝の深部および血管周囲領域で起こり、CBDにおける分布とは異なります (Tartaglia, 2014)。
CBDは、PSP、FTD、ADなどの他のタウオパチーとタウの沈着を共有していますが、非対称性の運動および認知症状、および大脳皮質と大脳基底核におけるタウ病理の分布において、特に臨床的および病理学的に異なる特徴を示します。これらのタウオパチーを鑑別するには、臨床症状、脳領域の関与、細胞レベルのタウ病理の慎重な分析が必要です。これらの重度の神経変性疾患の早期診断とより良い治療戦略には、バイオマーカーのさらなる研究と開発が必要です(Stamelou, 2021)。
PSPとCBDを区別するために使用できるイメージングバイオマーカーは?
神経変性疾患の生前診断における病理の予測を支援する疾患特異的バイオマーカーの開発に対する関心が高まっています。現在、臨床試験においてタウ病理を標的とした治療法が開発されています(Höglinger, 2021)。 そのため 、発症前の患者や発症初期の段階でPSPおよびCBDの病理を検出できる診断用バイオマーカーが切実に必要とされています。高度な神経画像技術により、PSPおよびCBDに関連する病態生理学的メカニズムと臨床症状に関する洞察が得られています(Parmera, 2022)。
PSPとCBDの研究対象となっている主な画像バイオ マー カーには、磁気共鳴画像法(MRI)などの構造画像法、および陽電子放射断層撮影(PET)や単光子放射型コンピュータ断層撮影(SPECT)を用いた機能画像法および分子画像法があります(Parmera, 2022)。
C BD では、通常、大脳半球上部の萎縮パターンが認められ、特に後部前頭葉、上側頭葉、基底核が関与する非対称パターンが認められます。このパターンは、より影響を受けている肢と反対側の半球でより顕著であることが多いです。さらに、運動の重症度は、中心前回および中心後回の反対側の皮質の薄化および被殻の容積と負の相関があることが分かっています(Upadhyay, 2016)。
多様なMRI研究が、潜在的な病理を暗示する可能性のある、CBDの構造変化のパターンを特定するために利用されてきました。例えば、臨床病理学的研究により、CBDにおける灰白質損失パターンは潜在的な病理によって異なることが示されました(Whitwell, 2010)。死後、CBDまたはPSPと診断されたCBD 患者 は、前運動野および補足運動野に同様の限局性萎縮を示しました。一方、FTDおよびAD病理を基礎疾患とする患者は、それぞれ前頭側頭および頭頂側頭領域において、より広範囲の灰白質萎縮パターンを示しました(Whitwell, 2010)。
CBD(中心業務地区)の人口における 12か月間の灰白質密度の 変化 。灰白質密度における 統計的に有意な変化 (FDR閾値=0.05)は 、 解剖学的MRIテンプレート上に重ね合わせた 統計的パラメトリックマップ として示されています 。濃い紫色と濃い青色の領域 は 、灰白質密度の 最も大きな損失を示しています。
CBD患者は、非対称の前頭頭頂皮質の萎縮および中脳および後部脳梁(CC)の薄化を示す傾向があります(Yamauchi, 1998;Dickson, 2002)。CBDと、重度の視床および橋の萎縮を特徴とするPSPコホートを比較した研究では、CBD患者は主に脳梁の萎縮を示し、中脳の萎縮は軽度であることが分かりました。このコホート では 、CBD患者は他のグループ(PSPやMSAなど)と比較してCC表面積が減少していました。CC表面積が470 mm²未満であることは、感度は67%と低かったものの、CBDに非常に特異的(95%)であることが分かりました(Constantinides, 2018)。
別の研究では、ボクセルベースの解析を用いて、剖検で確認されたPSPおよびCBD症例のMRIスキャンから得られた灰白質および白質萎縮のパターンを比較しました。その結果、CBDでは、特に後部前頭葉および頭頂葉領域、ならびに大脳基底核(特に被殻および淡蒼球)において、より顕著な皮質灰白質萎縮が認められることが分かりました(Josephs, 2008)。 また 、CBDでは脳幹の萎縮が認められないという点で、PSPとCBDには顕著な違いがあることも指摘されています(Josephs, 2008)。
[18F]FDG PETは、非対称の前頭頭頂葉低代謝を伴うことが多いCBDに関連する代謝パターンを特定できることが示されています(Niethammer, 2014)。 また、後部側頭頭頂葉低代謝をより多く示すADなどの他の疾患とCBDを区別することで、診断精度が向上します(Pardini, 2019, Parmera, 2021)。 この 明確な代謝シグネチャーを検出する能力により、CBDおよび関連疾患の診断の特異性が向上します。
最近の 研究では、神経画像バイオマーカーを使用して、PSPとCBDを区別する能力が向上しています。 構造画像、特にMRIでは、CBDは前頭頭頂領域の非対称性萎縮と脳梁の薄化が典型的であることが明らかになっています。 一方、PSPでは中脳と橋にさらに深刻な萎縮が見られます。 ボクセルベースの分析では、PSPの脳幹の著しい萎縮とは対照的に、CBDでは広範囲の皮質灰白質の萎縮が強調され、これらの知見を裏付けています。
これらの画像診断技術は貴重な知見をもたらしますが、その精度と信頼性を向上させるためにはさらなる研究が必要です。死後の確認に頼ることを減らすためには、早期発見のための非侵襲的な診断ツールの開発が引き続き優先事項となります。
MRSはCBDの評価にどのように使用されるのでしょうか?
磁気共鳴スペクトロスコピー(MRS)は、特にプロトン(1H)MRSは、脳内で起こる生化学的変化を明らかにする非侵襲的な画像化技術です。 CBDの評価という観点では、MRSは主に、神経細胞の健康状態と完全性を示す主要代謝物の濃度を測定するために使用されます。 MRSで注目される代謝物は以下の通りです 。
- N - アセチルアスパラギン酸(NAA):主にニューロンに存在し、NAAはニューロンおよび軸索の密度のマーカーと見なされています。NAAのレベルが低下すると、ニューロンの損失または機能不全が示唆され、これはCBDなどの神経変性疾患の特徴です(Ross、2004)。
- コ リン (Cho):コリンは主に細胞膜の構成成分と関連しており、リン脂質の合成と分解に関与しています。コリンのレベル上昇は、神経変性プロセスや炎症の結果として起こる可能性がある膜のターンオーバーの増加を示している可能性があります(Buonocore, 2015)。
- クレアチン(Cre):クレアチンおよびクレアチンリン酸はエネルギー代謝に関与しています。通常、クレアチンレベルは安定しており、MRS研究では内部参照として頻繁に使用されます。しかし、クレアチンレベルは特定の病態下で変動することがあります(Provencher, 2001)。
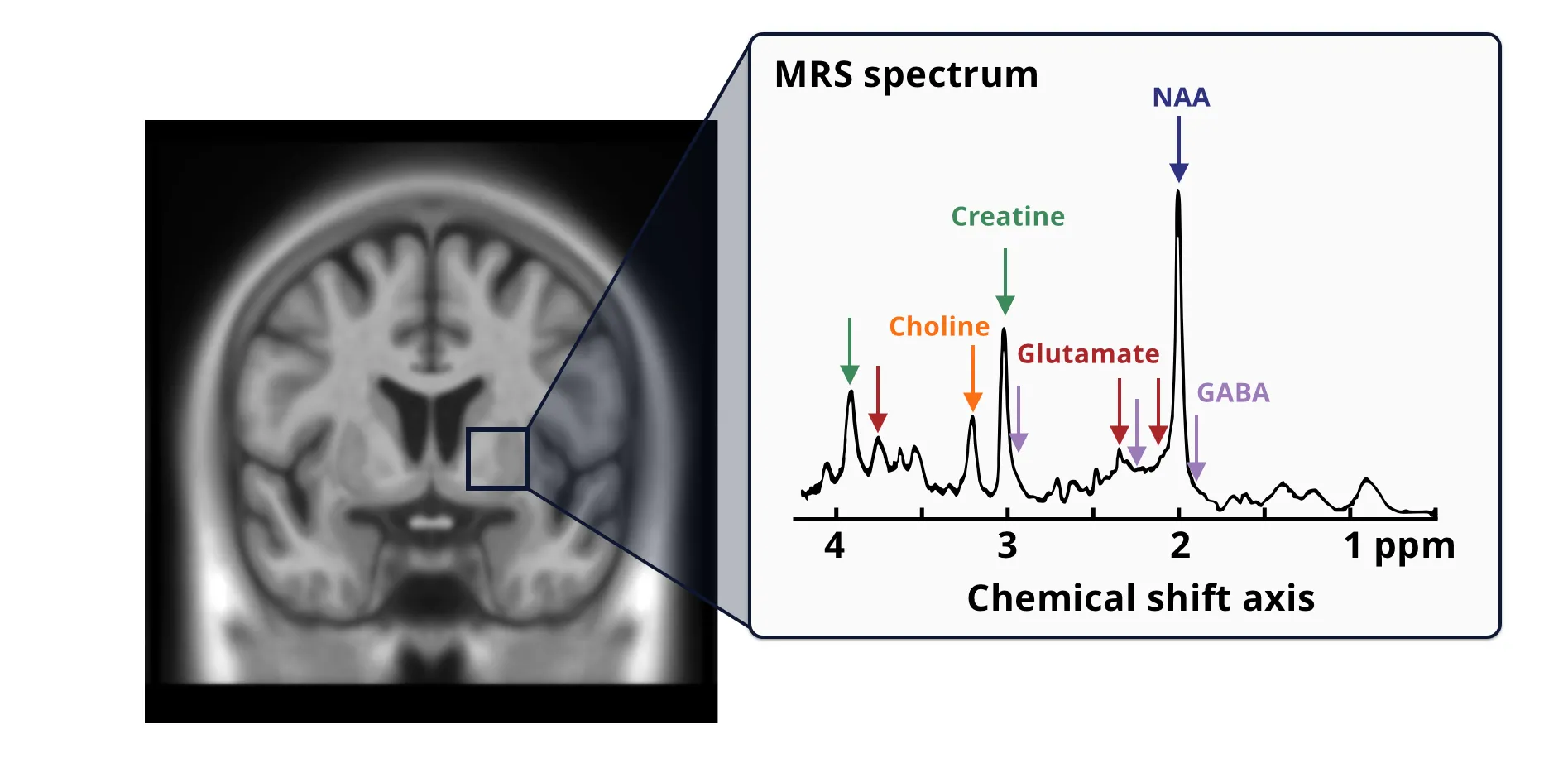
代謝物シグナル は 、 関心領域(VOI、青枠) から取得した 1H-MRSスペクトル を使用して取得します。MRSスペクトルは 、VOI内の すべての組織タイプと細胞区画にわたる複合シグナルを反映します 。代謝物は 、化学的特性に関する事前知識 と 、 化学シフト軸に沿ったピーク を既知 の標準物質 と照合することによって 同定され、 その量は百万分率(ppm)で測定されます。代謝物の ピーク は、 コリン(オレンジ)、クレアチン(青緑)、グルタミン酸(赤)、 N-アセチルアスパラギン酸(NAA、青)、抑制性神経伝達物質であるγ-アミノ酪酸(GABA、黒 ) に属するものとして(左から右に) 同定されます。 同じ色の複数の矢印 は、 同じ代謝物 に関連する複数のピーク を示しています。図のグラフ は 、Ip et al., 2022の図1をクリエイティブ・コモンズ表示ライセンスに基づき使用 しています。
CBD患者におけるMRSを用いた 研究 では、代謝物の変化に特定のパターンがあることが示されています。
- NAA/クレアチン(NAA/Cre)およびNAA/コリン(NAA/Cho)の比率の低下は、研究全体を通じて一貫して報告されています。 これらの 変化は、特に大脳基底核、前頭皮質、中心楔前部、頭頂皮質、および側頭葉皮質などの領域で観察されています。大脳基底核は、CBDの病理との関連性を反映して、すべての研究で共通して関心領域として取り上げられている部位です(Tedeschi, 1997;Abe, 2000;Kizu, 2002)。
- 2つの研究では、前頭皮質のNAA/Creの減少が報告されていますが、頭頂葉皮質およびシルビウス領域でも代謝産物の変化が認められました。これらの変化の非対称 性 、特に頭頂葉皮質におけるものは、CBDを、進行性核上性麻痺(PSP)、多系統萎縮症(MSA)、および前頭側頭型認知症(FTD)などの他の神経変性疾患と区別するのに役立ちます(Tedeschi, 1997;Abe, 2000)。
パーキンソン病、PSP、CBDを比較 した 研究では、
- C BD 患者では、中心楔前部におけるNAA/Creおよびレンズ核および頭頂皮質(特に最も影響を受けている側と反対側)におけるNAA/Choが著しく減少していることが示されました。この観察結果は、MRSがこれらの領域における神経細胞の損失と細胞膜のターンオーバーの特定のパターンを検出できる可能性を示唆しており、CBDと他の疾患の鑑別に役立つ可能性があります(Tedeschi, 1997)。
- これらの代謝産物の比率に関して、パーキンソン病患者と対照群の間には有意 な 差は認められませんでした。このことは、MRSはCBDとPDおよびPSPの鑑別に有用である可能性を示唆しています。
MRSはCBDにおける脳の局所代謝と神経細胞の健康状態に関する貴重なデータを提供しますが、1H-MRSを使用して個々の患者を区別する能力は依然として限られています。しかし、大脳皮質および皮質下の関与の明確なパターンを検出できるこの技術は、CBDおよび潜在的には他の神経変性疾患の診断評価における役割を裏付けています。
当社のチームは、CBDを他のタウオパチーと区別するためのイメージングバイオマーカーに関するご質問や、当社の他のイメージングサービスに関する具体的な情報提供など、どのようなご質問にも喜んでお答えいたします。
当社のイメージングサービスについてさらに詳しく知る
関連コンテンツ
神経疾患の臨床試験における神経画像診断の使用に関するベストプラクティスの最新情報。
神経疾患におけるタンパク質の異常折りたたみのモデリング
神経変性におけるタンパク質のミスフォールディングのメカニズムの計算モデル化と、疾患修飾治療薬の発見と開発への応用。
前頭側頭型認知症における神経画像診断と臨床試験
前頭側頭型認知症(FTD)の変異型に対する理解におけるMRIおよびPET画像診断によるバイオマーカーの有用性、およびFTD臨床試験におけるエンドポイントとしてのその使用。
MS臨床試験におけるガドリニウム造影MRI病変
多発性硬化症(MS)の臨床試験におけるガドリニウム(Gd)による病変の増強が、疾患の進行と治療介入への反応を追跡するためにどのように使用されているか。
進行性核上性麻痺(PSP)の画像診断バイオマーカー
PSPの臨床試験において、疾患修飾療法の有効性を評価するために利用可能な各種の脳画像診断法(MRI、PET、SPECT)の概要。
MCIとアルツハイマー病におけるタウPETの経時的変化
軽度認知障害(MCI)およびアルツハイマー病(AD)におけるタウPETトレーサーの取り込みと結合の変化に関する自然史の概要。
多系統萎縮症(MSA)の臨床試験におけるMRI
この資料では、MSAの研究におけるバイオマーカーとしての体積MRIと拡散強調画像(DWI)の有用性について概説しています。