この資料では、以下の内容について説明しています。
DMDの遺伝的原因と臨床的特徴は何ですか?
デュシェンヌ型筋ジストロフィー(DMD)は、まれなX連鎖劣性遺伝の神経筋疾患で、筋肉の進行性筋力低下を特徴とする疾患です。新生児男子出生3,500~5,000人に1人の割合で発症します(Hoffman, 1987;Duan, 2021)。ヒトで最も大きな遺伝子として知られるDMD遺伝子は、高い変異率とさまざまな変異座を示し、新規変異はDMDの症例の約3分の1を占めています(Muntoni, 2003 )。DMD遺伝子における変異のほとんどはフレームシフト変異またはナンセンス変異であり、筋肉の完全性と活力を維持するために不可欠な主要な構造タンパク質複合体であるジストロフィンが欠損、不安定、または大幅に減少します(Blake, 2002 )。短縮ジストロフィンは、アクチン細胞骨格と結合組織を結合するドメインを欠いているため、機能しないか不安定なタンパク質となります。筋肉への機械的ストレスは、筋肉の損傷、炎症、脂肪および線維組織の骨格筋線維への浸潤を累積的かつ慢性的に引き起こします(Koenig, 1988 ;Muntoni, 2003 )。さらに、幼少期からの変性と再生の繰り返しにより、再生衛星細胞の数が減少し、再生能力が徐々に低下します(Molinaro, 2024 )。筋萎縮とこの疾患の再生能力の低下が相まって、DMDの進行を促します。
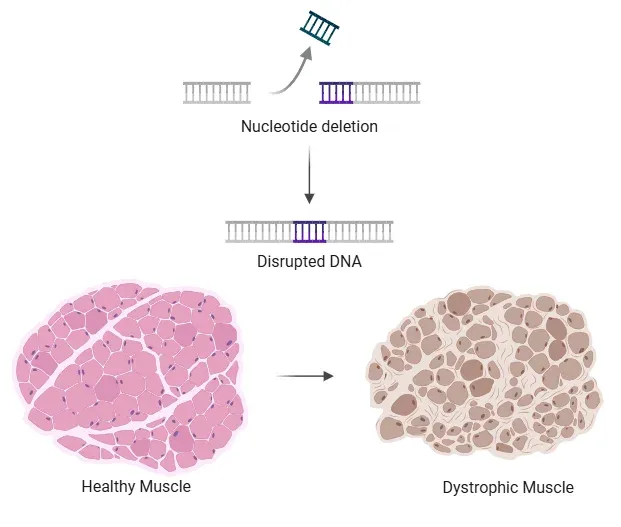
DMD遺伝子における ヌクレオチドの欠失により、読み取り枠が崩壊し、機能的なジストロフィンが欠如する結果、DMDにおける健康な筋肉と筋肉の完全性の喪失を示す模式図。
DMDの最初の臨床症状は2~3歳で現れ始め、歩行の遅れ、階段の昇りにくさ、ガウアー徴候、デュシェンヌ型歩行パターン (Bushby, 2010) などの特徴があります。この早期の症状が現れる段階では、特定のバイオマーカーによって、血液中のクレアチンキナーゼ(CK)レベルの上昇など、筋肉の損傷や炎症を示すことができます。 移動能力が高まるにつれ、ジストロフィンや損傷修復メカニズムが十分に機能しないため、粗大運動筋はますますストレスを受け、炎症を起こし、損傷していきます。
DMDの中期(通常7~12歳頃)には、四肢のさまざまな筋肉群に著しい萎縮、脂肪浸潤、線維化が起こります(Mendell, 2012 )。ふくらはぎの仮性肥大は、健康な筋肉組織が脂肪や結合組織に置き換わることで起こります(Davis, 1982 )。この段階では、歩行機能が徐々に低下します。
12歳頃までに、DMD患者のほとんどは歩行ができなくなり、筋肉の相当部分が脂肪に置き換わっているため、腕の可動性も徐々に失われていきます。筋肉は、心臓や肺などの臓器を含め、時間の経過とともに徐々に損傷が進行します。DMDの後期(通常は青年期後期/20代前半)には、通常、脚、上半身の歩行能力が完全に失われ、呼吸器および/または心臓の機能障害が著しく、死に至ります (Van Ruiten, 2017)。
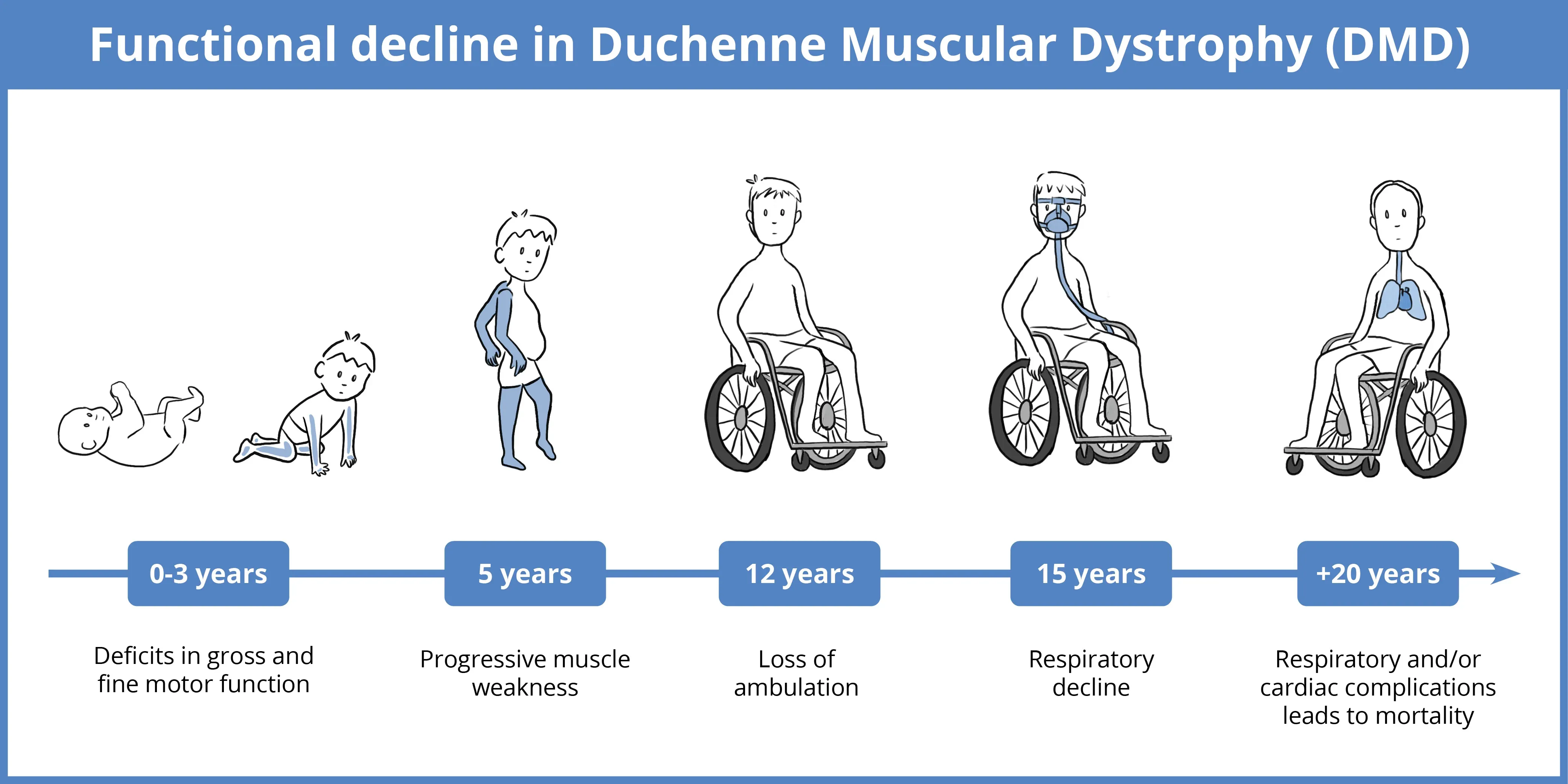
DMDの臨床経過の概略図。年齢の範囲、影響を受ける身体部位、病期を含みます。
DMDの症状と結果の経過は、決まったパターンにはなりません。進行に影響を与える要因には、年齢、初期の歩行機能、筋肉への負荷、ストレス、および組織線維の組成が含まれます(Benemei, 2024 )。治療などの介入は、歩行能力の喪失を遅らせるのにも有効です。DMD患者の寿命を延ばすには、多分野にわたる治療アプローチとモニタリングが有効です。新たな証拠は、バイオマーカーと筋組成測定の使用を支持しており、磁気共鳴画像法(MRI)は、疾患の進行、治療への反応、患者の臨床結果の予測について情報を提供する有効なツールとして役立つことが示されています(Sherlock, 2021 ;Landfeldt, 2024 )。
DMDの進行におけるバイオマーカーのモニタリングに有効なMR画像診断法はどれですか?
筋磁気共鳴画像法(mMRI)は、DMDにおける形態学的変化と疾患進行のモニタリングおよび定量化のための、確立された非侵襲的なツールです。 多数の研究により、さまざまなMRIモダリティ、機能的運動評価、臨床結果との相関性が実証されています(Ropars, 2020)。 しかし、疾患進行の不均一性と個人間のばらつきにより、画像プロトコルの標準化が困難になっています。現在、筋肉における進行性の形態学的変化を評価するには、段階別の画像技術を用いて疾患進行のバイオマーカーを評価する必要があります。これらの課題に対処するために、T1強調画像、T2強調画像、Dixon MRI、磁気共鳴スペクトロスコピー(MRS)、心臓MRIなど、さまざまなMRIモダリティを用いて、DMDのさまざまな側面を評価することができます。
T1強調MRI
T1強調(T1w)MRIは、DMDにおける筋肉の組成を評価するための定性的または定量的手法です(Senesac, 2020 )。 T1強調画像は、解剖学的および構造的情報に関する貴重なフィードバックを提供し、DMDの疾患進行の評価に広く使用されています。T1強調画像では、コントラストにより異なる組織を区別することができます。T1強調画像では、健康な筋肉は暗く見え、脂肪は筋肉内で高信号を示します。T1w画像は画像処理を必要とせずに筋肉内の脂肪浸潤の程度を評価できるため、画像診断施設でのモニタリング、研究、臨床試験に直接利用することができます(Mercuri, 2002 )。最近では、T2強調MRI、MRS、Dixon MRIなどの定量的かつ高感度なMRモダリティが、病態生理学や治療反応性に関するさらなる洞察をもたらす定量的なアウトプットを提供するために使用されています。
T2強調MRI
T2強調(T2w)画像は、横断的緩和時間(T2)を測定する定量的なMRI技術であり、DMDにおける組織、特に脂肪、浮腫、線維症における水分含有量を反映します。組織間の緩和時間の差異は、T2w画像上の異なる信号強度として現れます。脂肪(特にRARE画像上)および浮腫(遊離水含有量が高いことを反映)は、T2w 画像上で高信号として現れます。線維性組織は非常に高密度で水分含有量が少ないため、T2w画像では正常な筋肉よりも暗く見えます。
T2強調画像は、早期および中期のDMDの幅広い範囲の男児における筋の病態生理をモニタリングし、定量化する可能性を示しています。早期のDMDの男児、DMDの年長の男児、およびDMDではない男児を比較した研究では、DMDの男児の脚の筋肉におけるT2値は、同年齢の対照群と比較して高いことが分かりました。DMDの年長少年では、DMDの年少少年と比較してT2値がさらに上昇しました(Arpan, 2013 )。Willcocks et al.( Willcocks, 2014)は、2年間にわたって実施された縦断的研究でこれらの結果を裏付け、ヒラメ筋において、1年後および2年後の時点での平均T2値と上昇したボクセルの割合が著しく上昇していることを発見しました。注目すべきは、ヒラメ筋のT2値は各年齢層で研究期間中に増加しましたが、9~13歳の男児ではより若い年齢層よりも急速に増加し、確立された機能評価と相関していたことです。これらの知見は、T2強調画像が幅広い年齢層における臨床結果の測定に分析できる可能性を示唆しており、特に脚の筋肉に脂肪が蓄積している間は有効です(Willcocks, 2014)。しかし、筋肉が脂肪で飽和状態になると、特に小さい筋肉領域では、MRSやDixon MRIなどのMRシーケンスの方が、より感度の高い定量化に適しています。
磁気共鳴スペクトロスコピー
磁気共鳴スペクトロスコピー(MRS)は、MR画像の撮影中に化学シフトを分析することで、組織の分子組成を非侵襲的に調査することができます。化学シフトの値は、組織内の分子構造に関する情報を提供します。MRSは、数多くの疾患の研究に用いられる、確立された高感度な技術であり、組織のわずかな変化にも敏感に反応し、DMDの長期的な変化や治療への反応を追跡するのにも使用できます(Willcocks, 2016;Barnard, 2020)。
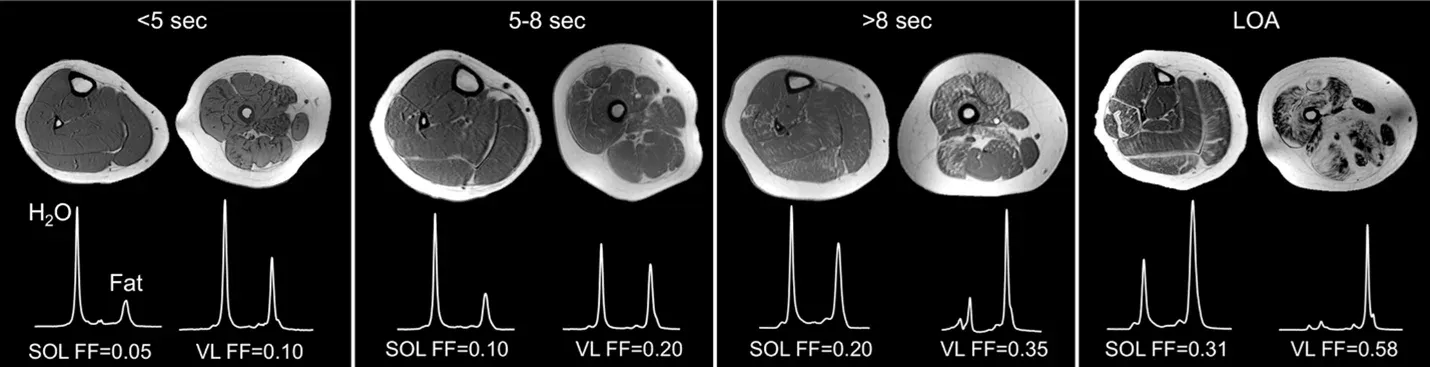
脂肪浸潤の増加に伴い(左から右へ)、ヒラメ筋(SOL)および外側広筋(VL)のふくらはぎと太ももにおけるMRS定量値を示すT1w画像の例。歩行能力の低下が示されています。10メートル歩行/走行時間は上部に示されています。画像はクリエイティブ・コモンズ表示ライセンスに基づき(Barnard, 2018)より改変。
160人の参加者の下肢筋の縦断的分析により、MRI T2マッピング、磁気共鳴スペクトロスコピー(MRS)による脂肪分画(FF)、および最大48ヶ月間の外来機能評価の関連性が裏付けられました(Barnard, 2020)。この研究では、大腿筋外側部の脂肪分画のベースラインからの12ヶ月間の変化の大きさが、その後の12ヶ月間の機能改善を予測するものでした。変化がほとんどないか、または小さい(変化が0.02未満)被験者は、機能パフォーマンスが安定した状態を維持するか、または改善しました。脂肪分画が増加した(0.15超)被験者の約90%は、機能が低下するか、または失われました。
脂肪分画に加えて、クレアチンホスホキナーゼ(CPK)/ホスホクレアチン(PCr)/クレアチン(Cr)のMRS測定値は、筋機能の低下に関連する筋肉内の代謝変化を反映することができます(Wyss, 1998 ;Wyss, 2000 )。DMD患者へのクレアチン補給の効果は、リンMRS(31P-MRS)で測定したPCr/無機リンの比率の増加として示され、筋肉のエネルギー代謝の改善を示しています(Banerjee, 2010 )。このアプローチの長期効果は不明ですが、この研究は、31P-MRSがDMDにおける筋肉のエネルギー代謝の代謝バイオマーカーの変化をモニタリングする上で貴重なツールとなり得ることを示しています。
Dixon MRI
Dixon MRI(またはケミカルシフトイメージング)は、異なるエコー時間で収集した複数のMRI画像を使用して水と脂肪のシグナルを分離する定量的手法であり、脂肪浸潤の正確な測定を可能にします。 Dixon MRIによる脂肪分画の結果は、前述のMR法とよく相関しますが、その感度により、他のモダリティとは一線を画しています。T2マッピングと比較すると、Dixon MRIは病気の進行に伴う筋肉の脂肪置換を直接定量化し、水分含有量の変化に対する感度は低くなります。さらに、MRSは筋肉の局所領域のみで代謝測定を行うため、より広範囲の筋肉浸潤や筋肉群の浸潤を捉えられない可能性があります(Willcocks、2016年)。Dixon MRI を使用して測定した脂肪分画は、MRS を使用した FF とよく相関しますが、Dixon は空間分解能が高いことから、近位上肢の筋群間の比較を行う際にも有用です(Willcocks, 2016)。 臨床研究における用途に応じて、Dixon MRI は、DMD における脂肪分画の精密な測定のための強力な画像ツールであり続けています。
心臓MRI(CMR)
心臓MRIでは、心電図(ECG)ゲートシーケンスを使用して、心臓の高解像度画像を取得します。DMDが進行すると、心臓のモニタリングが不可欠となります。なぜなら、心臓はDMD患者集団における主な死因であり、呼吸不全と並んで挙げられるからです(McNally, 2015 )。DMDにおける心臓への影響は、10歳前後で始まり、心電図異常や洞性頻脈を特徴とします(McNally, 2015 ;van Westering, 2015 )。心筋細胞レベルでの損傷は、重大な心機能障害に先行するため、DMDのモニタリング活動においては、その定量化が不可欠です(Khairallah, 2007 ;Jung, 2008 ;McNally, 2015 )。心筋タグ付けアプローチを用いてピークストレインを計算する心臓磁気共鳴画像法(CMR)は、造影剤(LGEイメージングなど)を使用せずに、DMDにおける心機能および収縮力の異常を検出する感度の高い測定法であることが示されています。Batra 氏らは、5年間にわたる縦断的研究で、左室機能が正常であれば、複合および局所的な歪みは早期に検出されることを明らかにしました。この研究は、心 筋症における心筋歪みが心機能障害の早期バイオマーカーであることを裏付けるものです。
DMDの現在の治療法にはどのようなものがあり、また、臨床試験ではどのような治療法が研究されているのでしょうか?
現在、DMDの治療法はありません。しかし、疾患修飾治療や支持療法により、寿命を延ばし、生活の質を高めることができます(Birnkrant、2018年 )。筋肉の修復メカニズムが損なわれていることを踏まえ、臨床試験では、筋肉の完全性をできるだけ長く維持するための早期発見と早期介入が重視されています。
効果的な治療法には、全身治療の必要性、治療効果の持続、治療の副作用の最小化など、いくつかの障壁を克服する必要があります(Heydemann, 2023 )。最も広く使用されている標準治療には、コルチコステロイドと理学療法が含まれます。コルチコステロイドは有効性が実証されており、疾患の進行を遅らせ、筋肉機能を維持するのに効果的ですが、治療のすべての障壁に対処できるわけではありません。長期的なコルチコステロイドの使用は、気分の変動、骨粗鬆症、体重増加などの重大な副作用を引き起こします(Heydemann, 2023 )。 物理療法や移動補助器具は、補助筋群を強化し、機械的ストレスを軽減することで、筋肉の損傷を遅らせるのに効果的です。 進行を遅らせ、症状を緩和する効果はありますが、現在の治療法はDMDの根本的な遺伝的原因に対処するものではないため、DMDの根本的な遺伝的原因に対処する他の治療法と併用する必要があります。
幹細胞修復や遺伝子治療などの新たな治療法は、DMDを疾患の分子レベルで直接治療することを目的とした有望な治療法のひとつです(Heydemann, 2023 )。 そのひとつに、機能的な短縮型ジストロフィン遺伝子を筋細胞に導入することを目的とした、マイクロジストロフィン遺伝子治療があります。Mendell ら(Mendell, 2020) は 、4人の外来患者の男児(4~7歳)に、骨格筋および心筋特異的プロモーターの下で導入したところ、生検した腓腹筋の筋線維の74~96%でマイクロジストロフィンの導入遺伝子が発現したことを示しました。すべての患者において、North Star Ambulatory Assessment(外来患者評価)で機能改善が認められ、クレアチンキナーゼ値の低下が治療後1年間持続しました。軽度から中程度の有害事象が報告されています。この研究の限界は、生検による筋肉のサンプルが少数であることです。この問題に対処するため、Willcocks ら(Willcocks, 2021) は、qMRIとqMRSを用いて、より大きな筋肉群におけるマイクロジストロフィン遺伝子導入の影響を評価しました。標準治療を受けた年齢をマッチさせた自然経過コホートと比較すると、マイクロジストロフィン遺伝子導入を受けた3人の少年では、MRSで測定した大腿二頭筋長頭および内転筋において、脂肪浸潤が最小限に抑えられていました。この報告における画像診断の結果は、新しい治療法の有効性を調べる上で、非侵襲的な定量的MRIおよび定量的MRSの価値を実証しています。DMD患者の治療戦略を最適化し、臨床結果を改善するためには、バイオマーカーイメージングと新薬を統合した研究を継続していくことが必要です。
デュシェンヌ型筋ジストロフィー(DMD)のMRIバイオマーカーに関するご質問や、その他のイメージングサービスに関する具体的な情報提供など、当社のチームが喜んで対応いたします。
当社のイメージングサービスについてさらに詳しく知る
関連コンテンツ
神経疾患の臨床試験における神経画像診断の使用に関するベストプラクティスの最新情報。
ハンチントン病の臨床試験におけるMRIバイオマーカー
ハンチントン病(HD)の臨床試験における構造的および拡散MRI画像のバイオマーカーの使用に関する概要。
結節性硬化症(TSC)の神経画像バイオマーカー
TSCの臨床試験における疾患修飾治療薬の効果をモニタリングするための、脳構造MRIおよび拡散強調画像バイオマーカーの概要。
フリードライヒ失調症の臨床試験におけるバイオマーカーのイメージング
フリードライヒ失調症(FRDA)の研究調査および多施設臨床試験におけるMRIおよびDTIイメージングバイオマーカーの使用に関する概要。
多系統萎縮症(MSA)の臨床試験におけるMRI
この資料では、MSAの研究におけるバイオマーカーとしての体積MRIと拡散強調画像(DWI)の有用性について概説しています。