Cette ressource décrit :
- Quelles sont les causes génétiques et les caractéristiques cliniques de la DMD?
- Quelles techniques d'imagerie par résonance magnétique sont efficaces pour surveiller les biomarqueurs de la progression de la DM?
- Quelles sont les approches thérapeutiques actuellement étudiées dans le cadre des essais cliniques sur la DMD?
Quelles sont les causes génétiques et les caractéristiques cliniques de la DMD?
La dystrophie musculaire de Duchenne (DMD) est une maladie neuromusculaire récessive liée à l'X rare, caractérisée par une faiblesse musculaire progressive, avec une incidence d'environ 1 sur 3 500 à 1 sur 5 000 naissances vivantes de garçons (Hoffman, 1987; Duan, 2021). Le gène DMD, le plus grand gène humain connu, présente un taux de mutation élevé et un locus de mutation variable, les mutations de novo constituant environ 1 cas sur 3 de DMD (Muntoni, 2003). Les mutations du gène DMD, le plus souvent des mutations par décalage du cadre de lecture ou des mutations non-sens, entraînent une absence, une instabilité ou une réduction significative de la dystrophine, un complexe protéique structurel essentiel au maintien de l'intégrité et du dynamisme musculaires (Blake, 2002). La dystrophine tronquée n'a pas le domaine permettant de relier le cytosquelette d'actine et le tissu conjonctif, ce qui entraîne une protéine non fonctionnelle ou instable. Le stress mécanique sur le muscle entraîne des lésions musculaires cumulatives et chroniques, une inflammation et une infiltration de graisse et de tissu fibreux dans les fibres musculaires squelettiques (Koenig, 1988; Muntoni, 2003). De plus, les cycles répétés de dégénérescence et de régénération, dès le plus jeune âge, épuisent le réservoir de cellules satellites régénératrices, ce qui diminue la capacité de régénération au fil du temps (Molinaro, 2024). L'atrophie musculaire, combinée à la diminution du potentiel de régénération de cette maladie, contribue à la progression de la DMD.
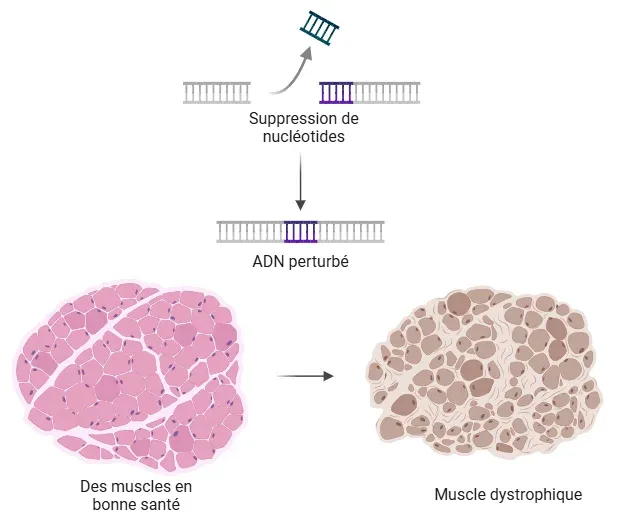
Schéma montrant le muscle sain par rapport à la perte d'intégrité musculaire dans la DMD due à la délétion d'un nucléotide dans le gène de la DMD , entraînant une rupture du cadre de lecture et l'absence de dystrophine fonctionnelle.
Les premiers signes cliniques de la DMD commencent à apparaître entre 2 et 3 ans, caractérisés par un retard de la marche, des difficultés à monter les escaliers, un signe de Gowers ou une démarche de type Duchenne (Bushby, 2010). À ce stade précoce des symptômes, des biomarqueurs spécifiques peuvent indiquer des lésions musculaires et une inflammation, tels que des taux élevés de créatine kinase (CK) dans le sang. À mesure que la mobilité augmente, sans dystrophine adéquate et sans mécanismes de réparation des lésions, les muscles de la motricité globale sont de plus en plus sollicités, enflammés et endommagés.
Au stade intermédiaire de la DMD (généralement vers l'âge de 7 à 12 ans), on observe une atrophie importante de divers groupes musculaires, une infiltration graisseuse et une fibrose des extrémités (Mendell, 2012). La pseudohypertrophie des mollets résulte du remplacement des tissus musculaires sains par de la graisse et des tissus conjonctifs (Davis, 1982). À ce stade, la fonction ambulatoire diminue progressivement.
Vers l'âge de 12 ans, la plupart des personnes atteintes de DMD perdent leur capacité de marcher et ont de moins en moins de mobilité dans les bras en raison d'une proportion considérable de muscle remplacée par de la graisse. Les muscles, y compris les organes tels que le cœur et les poumons, sont progressivement endommagés avec le temps. Dans la phase avancée de la DMD (généralement à la fin de l'adolescence/au début de la vingtaine), il y a généralement une perte totale de la capacité de marcher avec les jambes, le haut du corps, ainsi qu'un dysfonctionnement respiratoire et/ou cardiaque important, ce qui entraîne la mort (Van Ruiten, 2017).
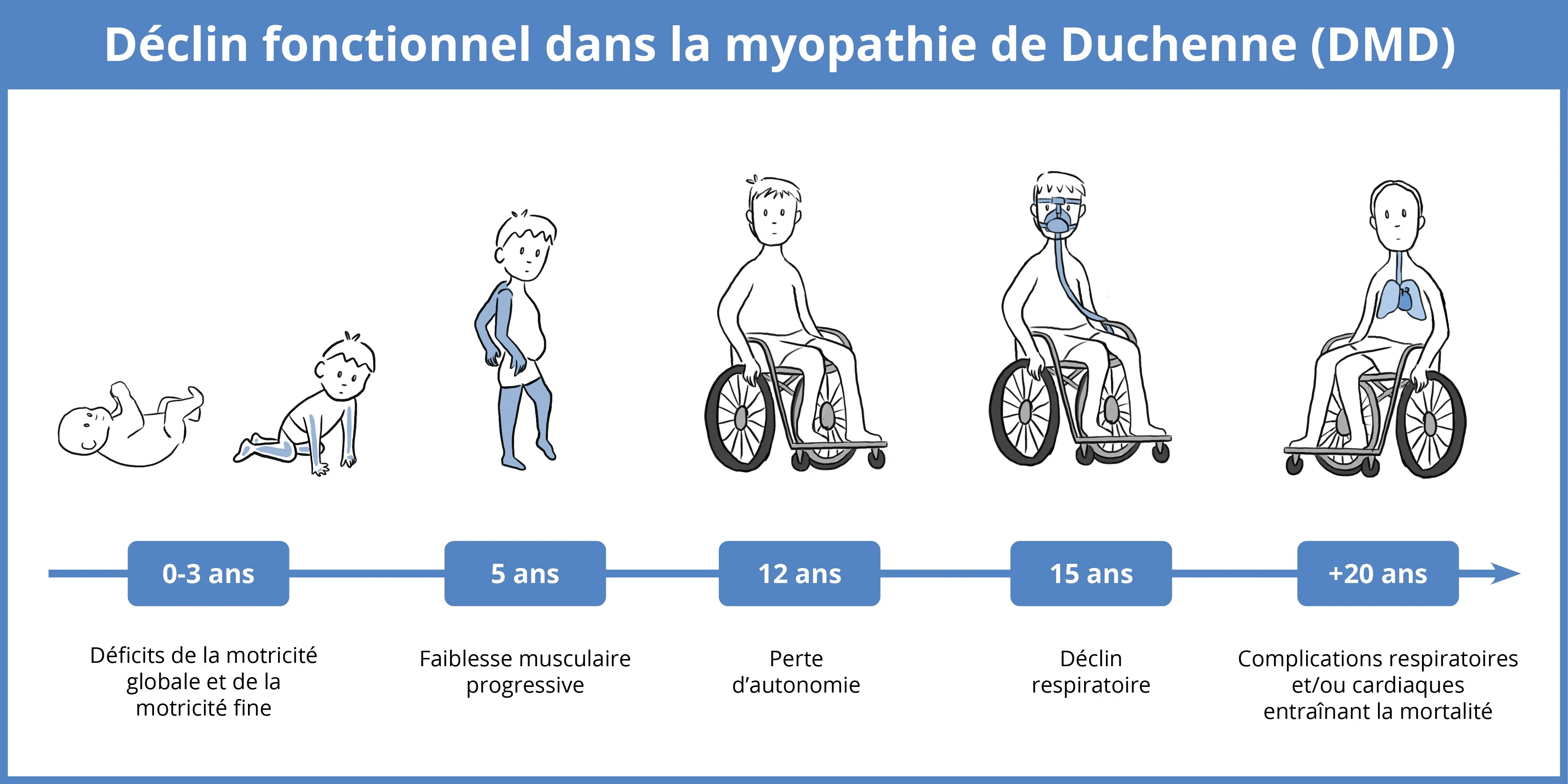
Schéma de la progression clinique de la DMD, y compris la tranche d'âge, les zones du corps touchées et les stades de la maladie.
La trajectoire des symptômes et des résultats de la DMD ne suit pas un schéma stéréotypé. Les facteurs qui influencent la progression comprennent l'âge, la fonction ambulatoire initiale, la charge musculaire, le stress et la composition des fibres tissulaires (Benemei, 2024). Les interventions, telles que le traitement, ont également été efficaces pour retarder la perte de la capacité de marcher. Les approches de traitement multidisciplinaires et la surveillance ont permis de prolonger la vie des personnes atteintes de DMD. De nouvelles preuves soutiennent l'utilisation de biomarqueurs et de mesures de la composition musculaire, l'imagerie par résonance magnétique (IRM) étant un outil efficace pour informer sur la progression de la maladie, les réponses aux traitements et la prédiction des résultats cliniques pour les patients (Sherlock, 2021; Landfeldt, 2024).
Quelles techniques d'imagerie par résonance magnétique sont efficaces pour surveiller les biomarqueurs de la progression de la DMD?
L'imagerie par résonance magnétique musculaire (IRMm) est un outil non invasif bien établi pour surveiller et quantifier les changements morphologiques et la progression de la DMD. De nombreuses études ont démontré des corrélations entre diverses modalités d'IRM, les évaluations motrices fonctionnelles et les résultats cliniques (Ropars, 2020). Cependant, l'hétérogénéité de la progression de la maladie et la variabilité interindividuelle présentent des défis pour la standardisation des protocoles d'imagerie. Actuellement, les changements morphologiques progressifs dans le muscle nécessitent des techniques d'imagerie spécifiques à chaque stade pour évaluer les biomarqueurs de la progression de la maladie. Pour relever ces défis, diverses modalités d'IRM, notamment l'imagerie pondérée en T1, l'imagerie pondérée en T2, l'IRM de Dixon, la spectroscopie par résonance magnétique (SRM) et l'IRM cardiaque, peuvent être utilisées pour évaluer différents aspects de la DMD.
IRM pondérée en T1
L'IRM pondérée en T1 (T1w) est une technique qualitative ou quantitative permettant d'évaluer la composition musculaire dans la DMD (Senesac, 2020). L'imagerie pondérée en T1 fournit des informations anatomiques et structurelles précieuses et est largement utilisée pour évaluer la progression de la maladie dans la DMD. Les images T1w permettent de distinguer les différents types de tissus par contraste ; sur une image T1w, le muscle sain apparaît sombre, tandis que la graisse a un signal hyperintense dans le muscle. Les images T1w peuvent être évaluées pour estimer l'étendue de l'infiltration graisseuse dans le muscle sans nécessiter de traitement d'image, ce qui permet de les utiliser pour la surveillance, la recherche et les essais cliniques directement sur le site d'imagerie (Mercuri, 2002). Récemment, des modalités d'IRM quantitatives et plus sensibles, telles que l'IRM pondérée en T2, la MRS et l'IRM de Dixon, ont été utilisées pour fournir des résultats quantitatifs susceptibles d'offrir des informations supplémentaires sur la physiopathologie et les réponses au traitement.
IRM pondérée en T2
L'imagerie pondérée en T2 (T2w) est une technique d'IRM quantitative qui mesure le temps de relaxation transversale (T2) reflétant la teneur en eau des tissus, en particulier la graisse, l'œdème et la fibrose, dans la DMD. La différence de temps de relaxation entre les tissus se traduit par des intensités de signal différentes sur les images T2w. La graisse (en particulier sur les images RARE) et l'œdème (qui reflète une teneur en eau libre plus élevée) apparaissent hyperintenses sur une image T2w. Le tissu fibreux est très dense et contient peu d'eau, apparaissant ainsi plus sombre que le muscle normal sur une image T2w.
L'imagerie T2w a démontré son potentiel pour surveiller et quantifier la physiopathologie musculaire chez un large éventail de garçons atteints de DMD à un stade précoce et intermédiaire. Des études comparant des garçons atteints de DMD précoce, des garçons plus âgés atteints de DMD et des garçons sans DMD ont révélé des valeurs T2 élevées dans les muscles des jambes des garçons atteints de DMD par rapport aux témoins du même groupe d'âge. Les valeurs T2 étaient encore plus élevées chez les garçons plus âgés atteints de DMD que chez les garçons plus jeunes atteints de DMD (Arpan, 2013). Willcocks et al. (Willcocks, 2014) ont confirmé ces résultats dans une étude longitudinale menée sur deux ans, qui a révélé que les valeursT2 moyennes et le pourcentage de voxels élevés augmentaient significativement à un an et deux ans dans le muscle soléaire. Il est à noter que les valeurs T2 du soléaire ont augmenté au cours de l'étude avec chaque groupe d'âge, mais plus rapidement chez les garçons âgés de 9 à 13 ans que dans les groupes d'âge plus jeunes et en corrélation avec les évaluations fonctionnelles établies. Ces résultats suggèrent que les images T2w peuvent être analysées pour mesurer les résultats cliniques dans une grande variété d'âges, en particulier lorsque la graisse s'accumule dans les muscles des jambes (Willcocks, 2014). Cependant, une fois que les muscles sont saturés de graisse, les séquences IRM, telles que la spectroscopie par résonance magnétique (SRM) et l'IRM de Dixon, deviennent plus pertinentes pour une quantification sensible, en particulier dans les zones musculaires plus petites.
Spectroscopie par résonance magnétique
La spectroscopie par résonance magnétique (MRS) permet d'explorer de manière non invasive la composition moléculaire des tissus en analysant le déplacement chimique lors de l'imagerie par résonance magnétique. La valeur du déplacement chimique fournit des informations sur la structure moléculaire d'un tissu. La spectroscopie par résonance magnétique (SRM) est une technique bien établie et très sensible utilisée pour étudier une myriade de maladies. Elle est sensible aux changements mineurs dans les tissus et peut être utilisée pour suivre les changements longitudinaux dans la DMD et les réponses aux thérapies (Willcocks, 2016; Barnard, 2020).
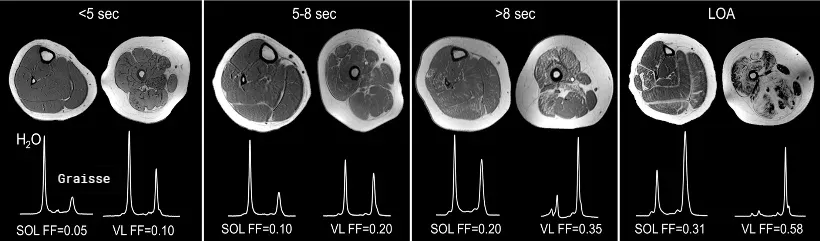
Exemples d'images T1w avec quantifications MRS du mollet et de la cuisse de participants présentant des infiltrations de graisse croissantes (de gauche à droite) dans le soléaire (SOL) et le vaste latéral (VL), ce qui entraîne une diminution de la capacité de marche. Les temps de marche/course sur 10 mètres sont indiqués ci-dessus. Image adaptée de (Barnard, 2018) sous licence Creative Commons Attribution.
Une analyse longitudinale des muscles des membres inférieurs chez 160 participants a confirmé le lien entre la cartographie T2 par IRM, la fraction grasse (FG) par spectroscopie par résonance magnétique (SRM) et les évaluations fonctionnelles ambulatoires jusqu'à 48 mois (Barnard, 2020). Dans cette étude, l'ampleur de la variation sur 12 mois par rapport aux valeurs de référence de la fraction de graisse dans le vaste latéral était prédictive de l'amélioration de la fonction au cours des 12 mois suivants. Les individus présentant des variations négligeables ou faibles (variation <0,02) sont restés stables ou ont amélioré leurs performances fonctionnelles. Près de 90% des individus dont la fraction de graisse a augmenté (>0,15) ont vu leur fonction diminuer ou disparaître.
Outre la fraction de graisse, les mesures de la créatine phosphokinase (CPK)/phosphocréatine (PCr)/créatine (Cr) par MRS peuvent refléter les changements métaboliques au sein du muscle, associés à une mauvaise fonction musculaire (Wyss, 1998; Wyss, 2000). Les effets de la supplémentation en Cr chez les patients atteints de DMD ont montré une augmentation du rapport PCr/phosphore inorganique, mesurée par la MRS phosphorique (31P-MRS), indiquant une amélioration du métabolisme énergétique musculaire (Banerjee, 2010). Bien que les effets à long terme de cette approche soient inconnus, cette étude montre que la 31P-MRS peut être un outil précieux pour surveiller les changements des biomarqueurs métaboliques du métabolisme énergétique musculaire dans la DMD.
IRM de Dixon
L'IRM de Dixon (ou imagerie par déplacement chimique) est une technique quantitative qui utilise plusieurs images IRM collectées à différents temps d'écho pour séparer les signaux de l'eau et des graisses, permettant ainsi la mesure précise de l'infiltration graisseuse. Bien que les résultats de la fraction graisseuse de l'IRM de Dixon soient en corrélation avec les méthodes IRM mentionnées précédemment, sa sensibilité la distingue des autres modalités. Par rapport à la cartographie T2, l'IRM de Dixon quantifie directement le remplacement de la graisse par le muscle au fur et à mesure de la progression de la maladie et est moins sensible aux changements de la teneur en eau. En outre, la MRS ne fournit des mesures métaboliques que dans une région localisée du muscle et peut ne pas capturer l'infiltration musculaire plus large ou l'infiltration dans les groupes musculaires (Willcocks, 2016). La fraction de graisse mesurée par IRM de Dixon est en corrélation avec la FF mesurée par MRS, mais l'IRM de Dixon est également utile pour permettre la comparaison entre les groupes musculaires de l'extrémité supérieure proximale en raison de sa haute résolution spatiale (Willcocks, 2016). Selon l'application dans les études cliniques, l'IRM de Dixon continue d'être un outil d'imagerie puissant pour mesurer avec précision la fraction de graisse dans la DMD.
IRM cardiaque
L'IRM cardiaque utilise des séquences synchronisées par électrocardiogramme (ECG) pour capturer des images haute résolution du cœur. À mesure que la DMD progresse, la surveillance du cœur devient vitale car les maladies cardiaques sont l'une des principales causes de décès chez les patients atteints de DMD, avec l'insuffisance respiratoire (McNally, 2015). L'atteinte cardiaque dans la DMD commence vers l'âge de 10 ans et se caractérise par des anomalies de l'ECG et une tachycardie sinusale (McNally, 2015; van Westering, 2015). Les lésions myocardiques au niveau cellulaire précèdent un dysfonctionnement cardiaque important, de sorte que leur quantification est essentielle dans les activités de surveillance de la DMD (Khairallah, 2007; Jung, 2008; McNally, 2015). L'imagerie par résonance magnétique cardiaque (IRM) utilisant une approche de marquage du myocarde pour calculer la déformation maximale s'est avérée être une mesure sensible pour détecter les anomalies de la fonction cardiaque et de la contractilité dans la DMD sans utiliser d'agent de contraste (comme dans l'imagerie par contraste tardif au gadolinium). Dans une étude longitudinale sur 5 ans, Batra et al. (Batra, 2022) ont identifié qu'avec une fonction ventriculaire gauche normale, la déformation composite et régionale est détectée à un âge précoce. Cette étude soutient la déformation cardiaque comme biomarqueur précoce du dysfonctionnement cardiaque dans la DMD.
Quelles sont les options de traitement actuelles pour la DMD et quelles sont les options qui font l'objet d'essais cliniques?
Actuellement, il n'existe pas de remède à la DMD. Cependant, des traitements modificateurs de la maladie et des thérapies de soutien sont disponibles pour prolonger la durée de vie et améliorer la qualité de vie (Birnkrant, 2018). Compte tenu de l'altération des mécanismes de réparation musculaire, les essais cliniques mettent l'accent sur la détection précoce et les interventions visant à préserver l'intégrité musculaire le plus longtemps possible.
Les traitements efficaces doivent surmonter plusieurs obstacles, notamment la nécessité d'un traitement systémique, le maintien de l'efficacité du traitement et la réduction des effets secondaires du traitement (Heydemann, 2023). Les traitements standard les plus utilisés sont les corticostéroïdes et les thérapies physiques. Les corticostéroïdes ont démontré leur efficacité et ont permis de ralentir la progression de la maladie et de préserver la fonction musculaire, mais ils ne permettent pas de surmonter tous les obstacles au traitement. L'utilisation à long terme de corticostéroïdes a des effets secondaires majeurs, tels que des sautes d'humeur, l'ostéoporose et la prise de poids (Heydemann, 2023). Les thérapies physiques et les dispositifs d'aide à la mobilité sont efficaces pour ralentir les lésions musculaires en renforçant les groupes de muscles de soutien et en réduisant le stress mécanique. Bien qu'ils soient efficaces pour ralentir la progression et soulager les symptômes, les traitements actuels ne s'attaquent pas à la cause génétique sous-jacente de la DMD et doivent être utilisés en conjonction avec d'autres thérapies qui s'attaquent à la cause génétique profonde de la DMD.
Les thérapies émergentes, telles que la réparation par cellules souches et les thérapies géniques, font partie des traitements prometteurs visant à traiter la DMD directement au niveau moléculaire de la maladie (Heydemann, 2023). L'une de ces approches est la thérapie génique par microdystrophine, qui vise à introduire une version fonctionnelle et raccourcie du gène de la dystrophine dans les cellules musculaires. Mendell et al. (Mendell, 2020) ont montré l'expression d'un transgène de microdystrophine dans 74 à 96 % des fibres musculaires gastrocnémiennes biopsiées lorsqu'il a été administré à quatre garçons ambulatoires (âgés de 4 à 7 ans) sous un promoteur spécifique des muscles squelettiques et cardiaques. Tous les patients ont montré une amélioration fonctionnelle dans l'évaluation ambulatoire North Star et une réduction des taux de créatine kinase pendant un an après le traitement, avec des effets indésirables légers à modérés signalés. Une limite de cette étude est que les données ne reflètent qu'un petit échantillon de muscle par biopsie. Pour remédier à ce problème, Willcocks et al. (Willcocks, 2021) ont utilisé la qMRI et la qMRS pour évaluer l'impact du transfert de gène de microdystrophine dans des groupes musculaires plus importants. Par rapport à une cohorte d'histoire naturelle du même âge traitée selon les normes de soins, trois garçons ayant reçu le transfert de gène de microdystrophine présentaient une infiltration graisseuse minimale observée dans le biceps fémoral long et l'adducteur magus mesurée par MRS. Les résultats d'imagerie de ce rapport démontrent la valeur de l'IRM quantitative non invasive et de la MRS quantitative dans l'examen de l'efficacité de nouvelles thérapies. Des recherches continues intégrant l'imagerie des biomarqueurs aux thérapies émergentes seront nécessaires pour optimiser les stratégies de traitement et améliorer les résultats cliniques pour les personnes atteintes de DMD.
Notre équipe se fera un plaisir de répondre à toutes vos questions sur les biomarqueurs IRM pour la dystrophie musculaire de Duchenne (DMD) ou de vous fournir des informations spécifiques sur nos autres services d'imagerie.
Découvrez nos services d'imagerie
Contenu connexe
Informations actualisées sur les meilleures pratiques liées à l'utilisation de la neuroimagerie dans les essais cliniques sur les maladies neurologiques.
Biomarqueurs IRM dans les essais cliniques de la maladie de Huntington
Un aperçu de l'utilisation des biomarqueurs d'imagerie IRM structurelle et de diffusion pour les essais cliniques de la maladie de Huntington (MH).
Biomarqueurs de neuro-imagerie pour la sclérose tubéreuse de Bourneville (STB)
Aperçu des biomarqueurs d'IRM et d'imagerie pondérée en diffusion pour évaluer l'efficacité des traitements neurologiques dans les essais cliniques de la STB.
Biomarqueurs d'imagerie pour les essais cliniques sur l'ataxie de Friedreich
Un aperçu de l'utilisation des biomarqueurs d'imagerie IRM et DTI pour l'ataxie de Friedreich (FRDA) dans les études de recherche et les essais cliniques multicentriques.
L'IRM dans les essais cliniques sur l'atrophie du système multiple (MSA)
Cette ressource donne un aperçu de l'utilité de l'IRM volumétrique et de l'imagerie pondérée en diffusion (DWI) en tant que biomarqueurs dans les études de recherche sur la MSA.