アルツハイマー病の臨床試験における画像診断の概要
アルツハイマー病(AD)の早期および後期の臨床試験では、マルチモダリティ画像診断が広く用いられています。画像診断の主な用途は以下の通りです。
- MRI
- 適格性評価
- 安全性評価(ARIA-EおよびARIA-Hを含む
- 有効性エンドポイントの定量的測定(例:体積MRI )
- PET
- 適格性および研究対象集団の強化
- 有効性エンドポイントの定量的測定(SUVR 、脳の広がりなど)
アルツハイマー病の臨床試験における神経画像診断の成功には、厳格な試験運営、強固なデータ追跡機能を備えた放射線画像の読影、高品質の画像から定量的測定値を導き出すための最新かつ検証済みの画像処理および分析ソフトウェアのシームレスな組み合わせが必要です。
アルツハイマー病の画像バイオマーカー
-
- 体積MRI(局所容積および皮質厚)
- アミロイドPET
- タウPET
- FDG PET
- ASL 灌流MRI
- fMRI(安静時および課題に基づく)
- 拡散イメージング(DTI、NODDI、自由水イメージングなど)
アルツハイマー病の画像研究におけるハイライト
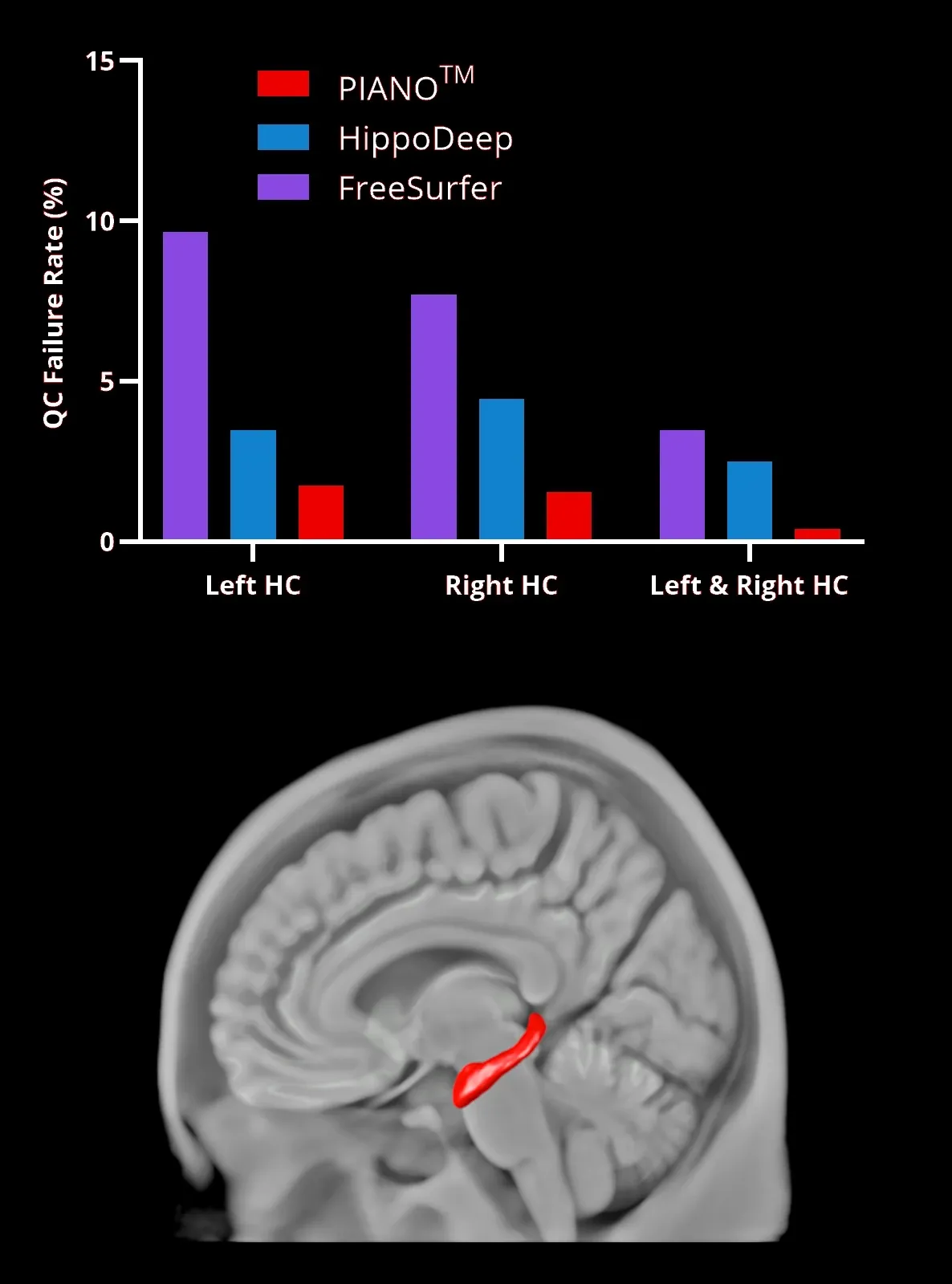
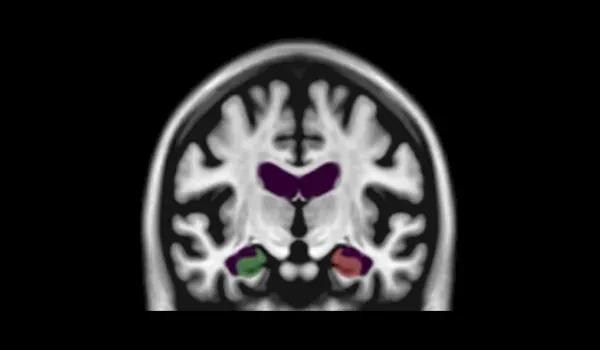
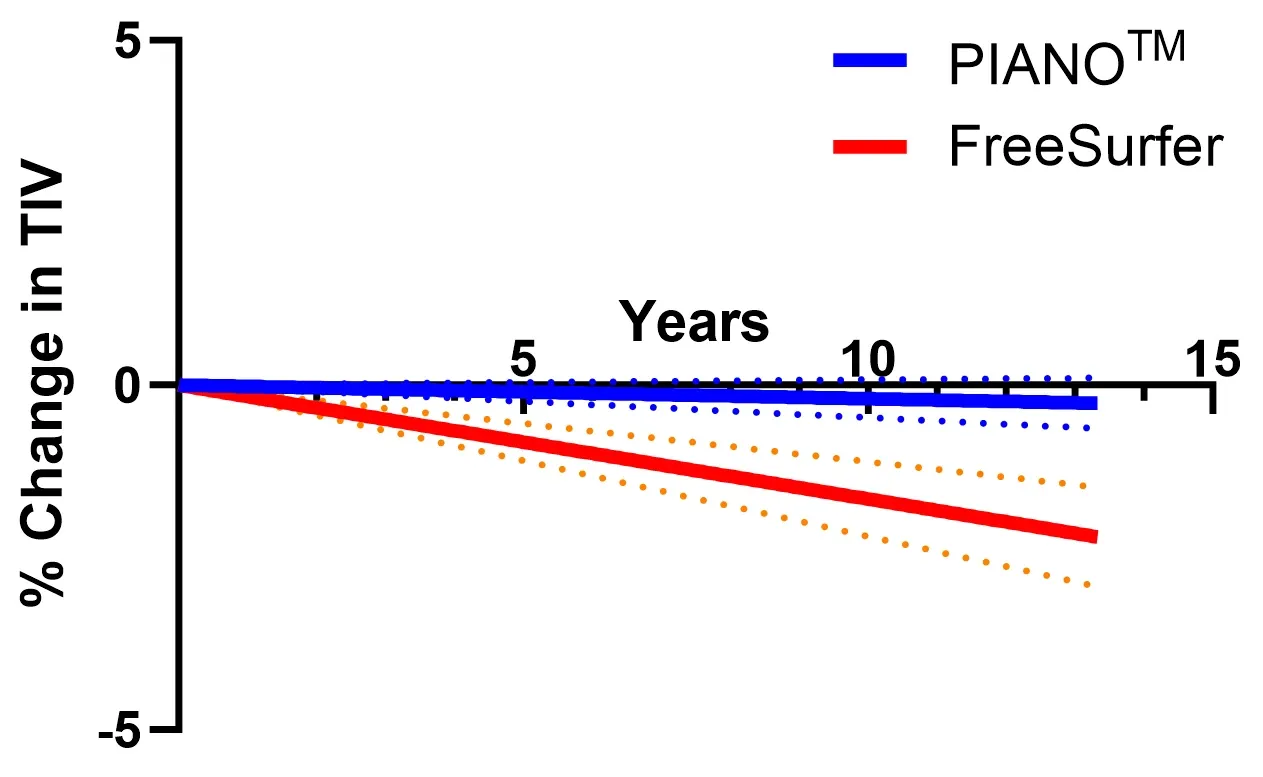
PIANO™ 、HippoDeep、 FreeSurferのセグメンテーション手法 を用いた 海 馬(HC、赤色の領域を3Dでレンダリング)のセグメンテーション の失敗率 。左と右のHCは、 同じデータセットで両側のセグメンテーションが同時に失敗した場合を表します 。
MR画像における海馬の頑強なセグメンテーションのためのディープラーニング
特に 畳み込みニューラルネットワーク(CNN) などのディープラーニングモデルは 、人間の脳の 機能識別プロセス を模倣することで 、生物医学 画像処理に 革命をもたらしました 。エンコーダー・デコーダー構造を持つ U -Netアーキテクチャは 、現実的な変形を加えた小規模なデータセットを効果的に訓練することで 、関心領域(ROI) のセグメンテーション を含む 神経画像 処理の応用 を高度化しました (Kruger et al., 2013;Lindsay, 2021; Ronneberger et al., 2015)。
私たちの研究は 、特に アルツハイマー病(AD)において、この領域の多様性により困難な課題である 海馬のセグメンテーションに焦点を当てています 。厳密に管理されたMRIスキャンのデータセットを使用し、品質管理と拡張トレーニングデータ により強化された ラベル付きデータでU-Netモデルを訓練しました。この手法 により、 海馬の萎縮など、従来のモデルでは失敗していた 困難なケースのセグメンテーション精度が向上しました (Thyreau et al., 2018)。
当社のディープラーニングモデルは 、FreeSurfer や HippoDeep などの 既存の手法を上回り 、手動修正なしで 、いずれの半球でも2%未満、 両半球で 0.4%未満の品質不良率 を達成しました 。品質管理不良率の大幅な削減は 、 データ処理不良率の低下により臨床試験のサンプルサイズを縮小できる可能性があるため 、臨床試験のコストに直接影響します 。このディープラーニングによる海馬セグメンテーション は、 海馬内の初期の急速な変化を示すFTDデータセット に適用されました 。
まとめると、当社の海馬セグメンテーション深層 学習モデルは 、従来の方法に代 わる再現性があり、偏りのない代替手段を提供し 、神経画像診断における課題に対処し 、より広範な ROI セグメンテーション作業に影響を与えます。
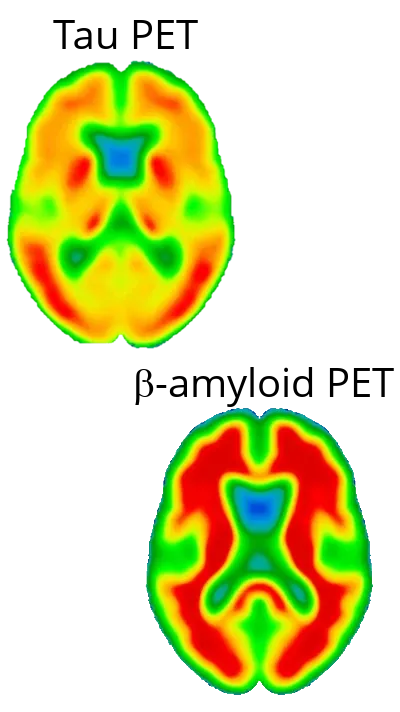
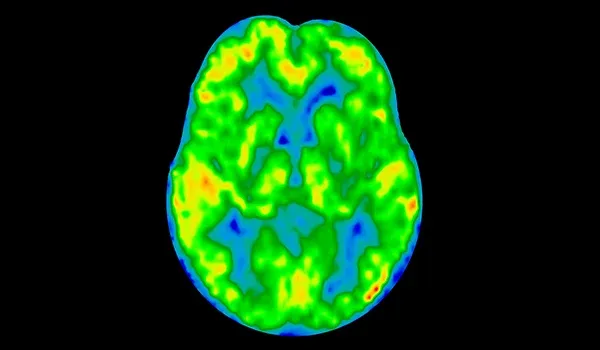
アルツハイマー病における神経変性は主にタウによって引き起こされるものであり、アミロイドβによるものではない
アルツハイマー病(AD)における神経変性は 、アミロイドβ(Aβ)の沈着よりもむしろ タウ病理によって主に引き起こされることが ますます 認識されるようになってきています 。アミロイドβプラーク は歴史的にADの特徴とされてきましたが(Gouras, 2015 )、その存在は 疾患の重症度や神経細胞の損失 と強く相関するわけではありません (Gulisano, 2018 )。むしろ 、神経原線維変化における 過剰リン酸化タウタンパク質の蓄積 は、 神経細胞の損傷、認知機能の低下、および疾患の進行 のパターンとより密接に関連しています (Liu, 2020;Moore, 2023)。タ ウ 病理は 、臨床症状の進行と一致して、多くの場合、嗅内皮質や 海馬 から始まり 、他の皮質領域へと広がる という、地域特異的な方法で 広がります (Vogels,2020 )。私たちの研究では 、神経変性の尺度 として皮質厚を用いた 広がりモデルと 相関分析により 、神経変性を引き起こすタウの役割が強く裏付けられました 。
この主張をさらに裏付けるものとして 、タウ凝集阻害剤、抗タウ抗体、タウキナーゼなど 、タウを標的とする治療戦略が 、 前臨床試験および初期の臨床試験で有望な結果を示しています (Congdon, 2023)。
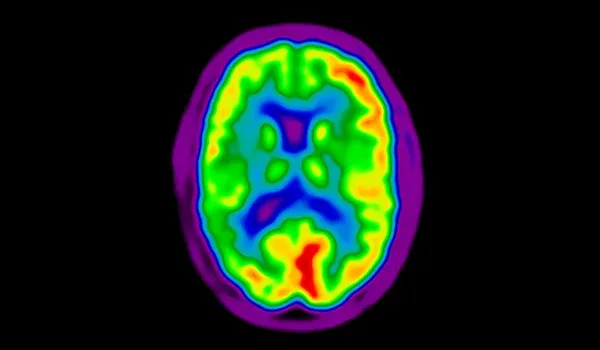
計算された平滑化カーネルにより、あらかじめ定義された共通のターゲット解像度に調和された 未加工のPET画像 。
ファントムを使用しない臨床試験におけるPET画像の空間分解能の調和
Biospective 社のSPITFIRE™は 、多施設研究における 脳ポジトロン放出断層撮影(PET)画像の 空間分解能を調和させるために設計された 革新的な 計算手法 です (Carbonell, 2024 )。従来の手法 では 、空間分解能の推定にホフマンファントムのデータを使用することが多く (Joshi, 2009; Harrison, 2020 )、 ファントム画像が利用できない場合や 、最適な結果が得られない可能性がある 場合には限界があります (Ruwanpathirana, 2024)。SPITFIRE™は 、PET画像そのものから 空間分解能を直接推定することで 、代替ファントムデータの必要性を排除し 、これらの課題 に対処します 。この手法は 、対数強度プロット技術を 3次元に 一般化し 、軸方向および面内方向の両方で空間分解能を 正確に推定することを可能にします 。SPITFIRE™を さまざまなコホート(異なる PETトレーサーやスキャナーモデル を含む)に適用 したところ 、同一のスキャナーモデルと再構成パラメータ を使用した被験者間でのばらつきが最小限に抑えられ 、一貫性のある信頼性の高い空間分解能の推定結果が得られました 。このアプローチ は 、 異なるセンター間でのPET画像の整合性を高める だけでなく 、 SPECTなどの幅広いトレーサーや画像モダリティ にも適用できる汎用性の高いフレームワークを提供します 。
アルツハイマー病の臨床試験における神経画像診断の使用と、当社の画像バイオマーカーについて、さらに詳しく知ることができます。
当社の治療領域についてさらに詳しく知る
関連コンテンツ
アルツハイマー病の臨床試験における治療薬の評価に関連するアルツハイマー病画像診断とベストプラクティスに関する最新情報。
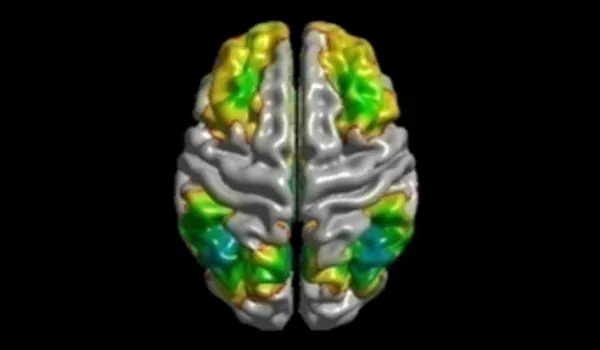
MCIとアルツハイマー病におけるタウPETの経時的変化
軽度認知障害(MCI)およびアルツハイマー病(AD)におけるタウPETトレーサーの取り込みと結合の変化に関する自然史の概要。