알츠하이머병 임상시험에서의 영상 개요
다중 모드 영상은 알츠하이머병(AD)의 초기 및 후기 임상 시험에서 널리 사용됩니다. 영상 촬영의 주요 용도는 다음과 같습니다.
- MRI
- 자격 요건 읽기
- 안전 읽기, ARIA-E & ARIA-H 포함
- 효능 평가 지표에 대한 정량적 측정(예: 체적 MRI)
- 애완동물
- 자격 및 연구 대상 인구 강화
- 효능 종점(예: SUVR , 뇌 범위)에 대한 정량적 측정
알츠하이머병 임상 시험에서 신경 영상 기술을 성공적으로 활용하기 위해서는 엄격한 연구 운영, 강력한 데이터 추적을 통한 방사선 판독, 그리고 고품질 이미지에서 정량적 측정치를 도출하기 위한 최첨단 검증된 이미지 처리 및 분석 소프트웨어의 원활한 조합이 필요합니다.
알츠하이머병의 바이오마커 이미지화
-
- 체적 MRI(국소 부피 및 피질 두께)
- 아밀로이드 PET
- Tau PET
- FDG PET
- ASL 관류 MRI
- fMRI (휴식 상태 및 작업 기반)
- 확산 영상(예: DTI, NODDI, 자유수 영상)
알츠하이머병 영상 연구의 하이라이트
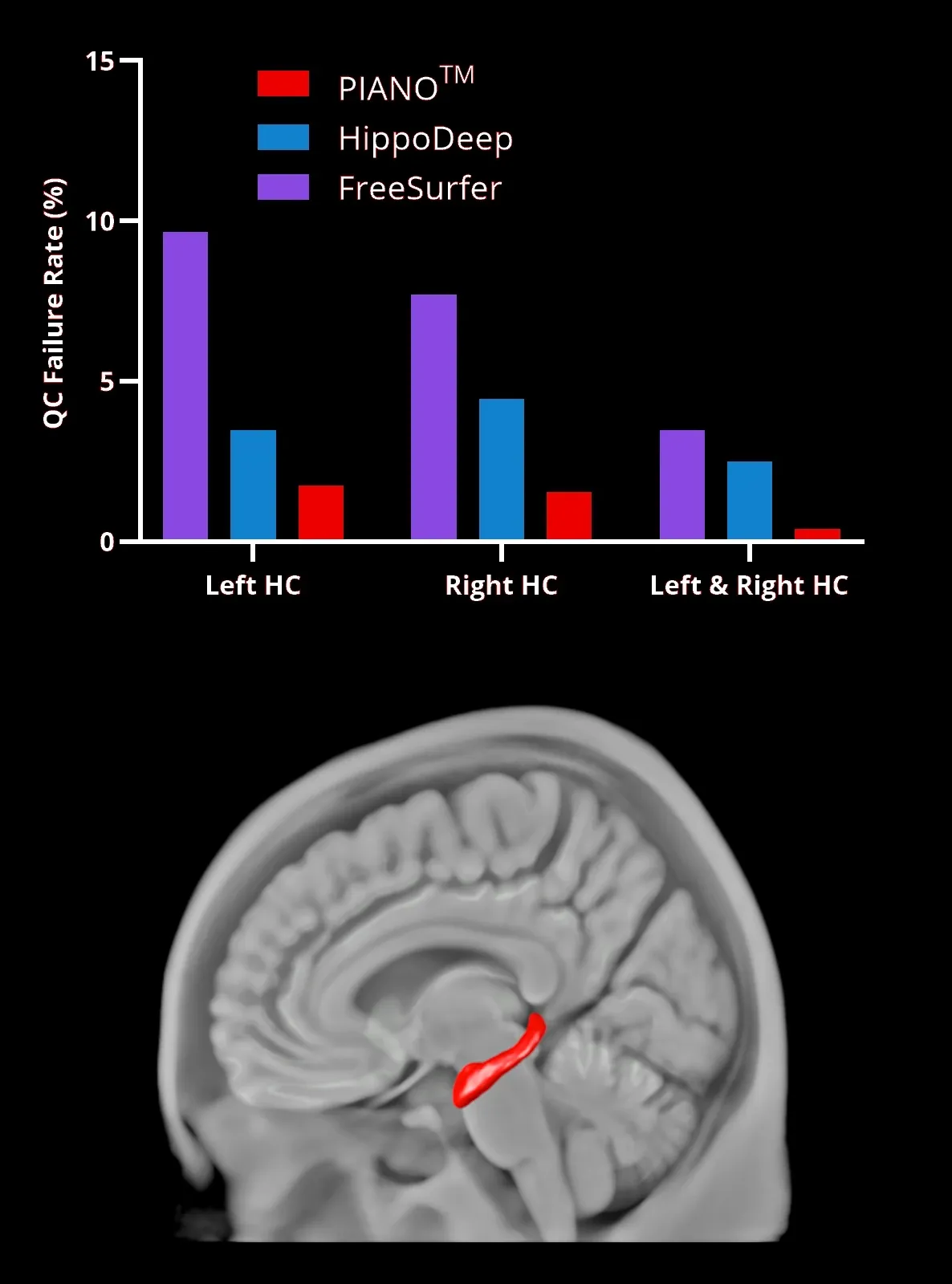
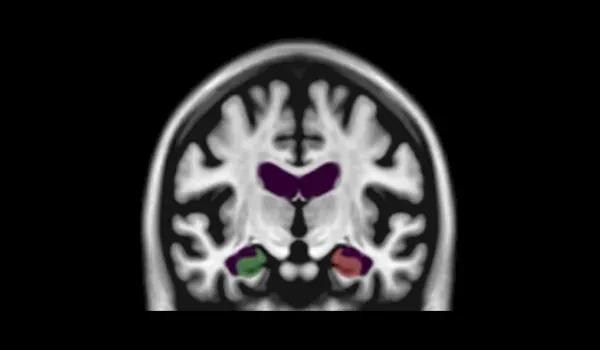
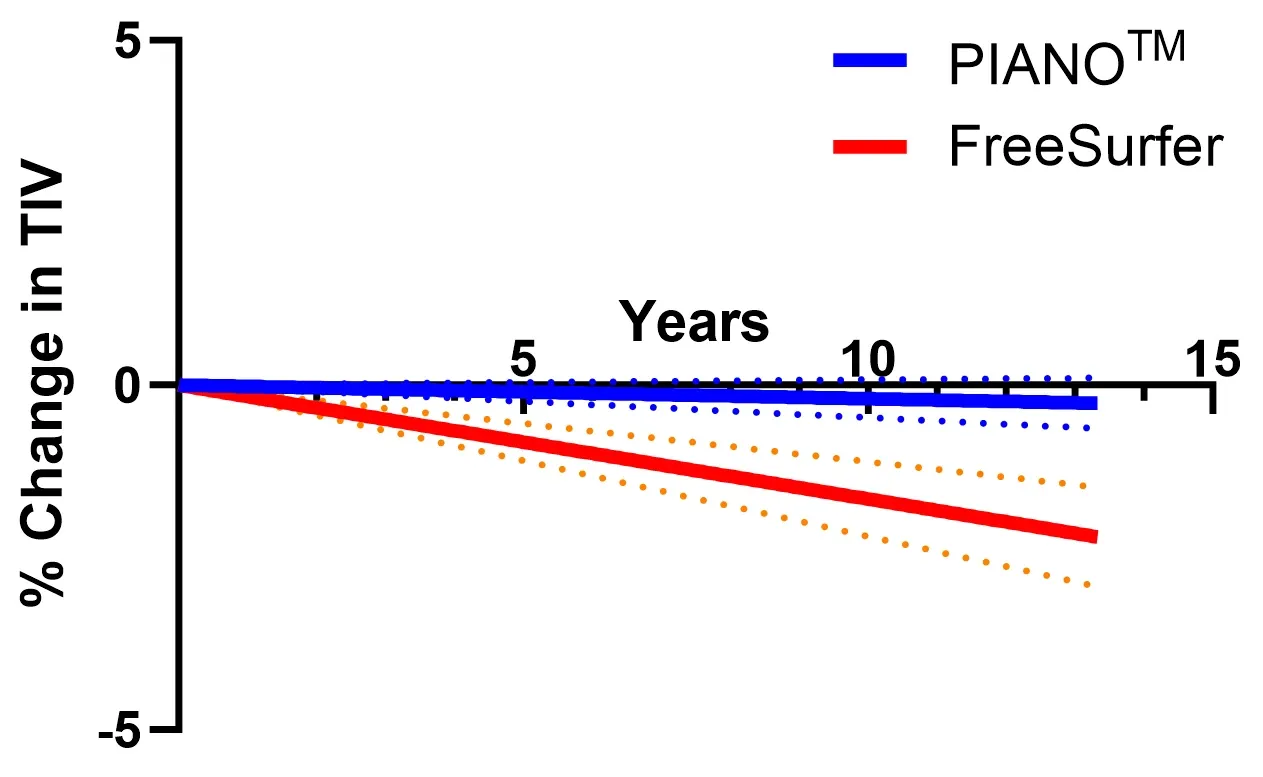
PIANO™, HippoDeep, FreeSurfer세분화 방법을 사용한 해마(HC, 빨간색 영역은 3D로 렌더링됨) 세분화 실패율 .왼쪽 및 오른쪽 HC는 동일한 데이터 세트에서 양쪽의 세분화가 동시에 실패한경우를 나타냅니다
MR 영상에서 해마의 확실한 분할을 위한 딥 러닝
딥러닝 모델, 특히 CNN(convolutional neural networks)은 인간의 뇌의 특징 식별 과정을 모방함으로써 생체 의학 이미지 처리에 혁명을 일으켰습니다 .인코더-디코더 구조를 가진 U -Net 아키텍처 는 현실적인 변형으로 보강된더 작은 데이터 세트에 대한 효과적인 훈련을 통해 관심 영역(ROI) 분할을 포함한 고급 신경 영상 응용 프로그램을 보유하고 있습니다 (Kruger et al., 2013);Lindsay, 2021; Ronneberger et al., 2015)
저희 의작업은 해마 분할에 초점을 맞추고 있습니다 .이 영역의 가변성 때문에 특히 알츠하이머병(AD)에서어려운 작업입니다 . 저희는선별된 MRI 스캔 데이터 세트를 사용하여 라벨링된 데이터로 U-Net 모델을 훈련시켰습니다. 이 모델은 품질 관리와 훈련 데이터의 확대로 강화 되었습니다 .이 방법은 이전 모델이 실패했던 해마 위축과 같은 어려운 사례의 분할 정확도를 향상시킵니다 (Thyreau et al., 2018)
우리의 딥러닝 모델은 FreeSurfer 나 HippoDeep 같은 기존 방법보다 성능이 뛰어나며 ,수동 수정 없이 양쪽 반구에서 2% 미만의 품질 실패율을 달성 하고 양쪽 반구 모두에서 0.4% 미만의 품질 실패율을 달성합니다. 품질 관리 실패율이 크게 감소 하면 임상 시험 비용에 직접적인 영향을 미칩니다. 데이터 처리 실패율이 낮아지면 잠재적으로 더 작은 시험 표본 크기를 사용할 수 있기 때문입니다. 이 딥러닝 해마 분할 은 해마 내의빠른 초기 변화를 보여주는 FTD 데이터 세트 에 적용되었습니다
요약하자면, 우리의 해마 분할 딥러닝 모델은 전통적인 방법에 대한 재현 가능하고 편견 없는 대안을 제공 하여 ,더 광범위한 ROI 분할 작업에 영향을 미치는신경 영상 분야의 문제를 해결합니다 .
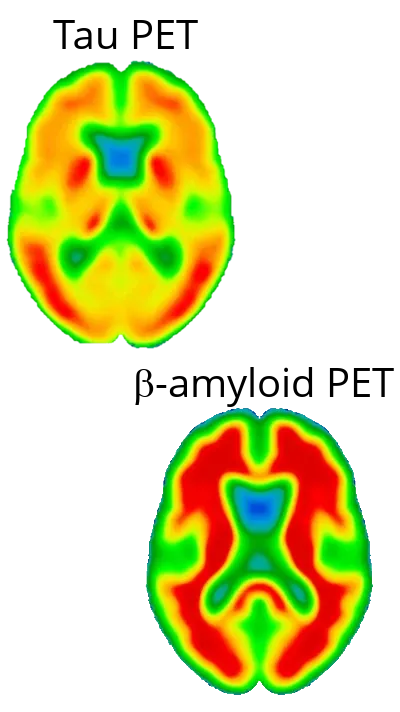
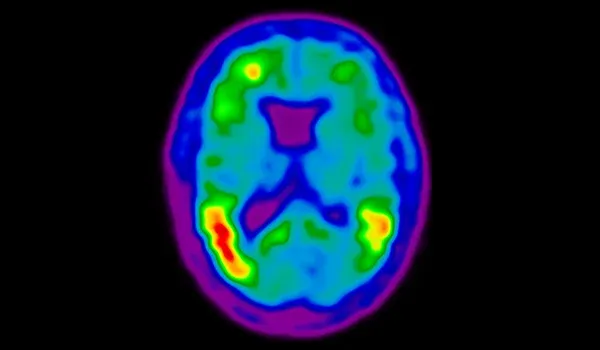
알츠하이머병의 신경 퇴화는 주로 아밀로이드 베타가 아니라 타우에 의해 유발됩니다.
알츠하이머병(AD)의 신경 퇴화는 아밀로이드-베타(Aβ) 침착보다는 타우 병리학에 의해 주로 유발된다는 사실이 점점 더 인식되고 있습니다 .아밀로이드-베타 플라크는 역사적으로 AD의 특징으로 여겨져 왔지만 (Gouras, 2015), 그 존재가 질병의 심각성이나 신경 손실 과 밀접한 관련이 있는 것은 아닙니다 (Gulisano, 2018). 대신 ,신경섬유 엉킴에 축적된 과인산화 타우 단백질 은 신경 손상, 인지 기능 저하, 질병 진행의 패턴과 더 밀접하게 연관되어 있습니다 (Liu, 2020; Moore, 2023). 타 우 병리학 은 지역별로 특정한 방식으로 확산되며 ,종종 다른 피질 영역으로 진행되기 전에 내측후두엽 피질과 해마 에서 시작하여 임상 증상의 진행과 일치합니다(Vogels,2020 ).우리의 연구에서, 확산 모델과 신경 퇴화의 척도로서 피질 두께를 이용한 상관관계 분석 은 타우가 신경 퇴화를촉진하는 데 중요한 역할을 한다는 것을 강력하게 뒷받침합니다
이러한 주장을 뒷받침하는 또 다른 근거로 ,타우 응집 억제제,항타우 항체, 타우 키나아제와 같은 타우를 표적으로 하는치료 전략 이 전임상 및 초기 임상 시험에서 가능성을 보여주고 있습니다 (Congdon, 2023).
원시 PET 이미지는 계산된 평활 커널을 통해 미리 정의된 공통 목표 해상도에맞춰 조화됩니다
팬텀이 없는 임상 시험에서 PET 이미지의 공간 해상도 조화
Biospective의 SPITFIRE™는 다기관 연구 에서 뇌 양전자 방출 단층 촬영(PET) 이미지를 조화시키기 위해 고안된 혁신적인 전산 방법 입니다 (Carbonell, 2024). 전 통적인 접근 방식은 공간 해상도를 추정하기 위해종종 호프만 가상 데이터에 의존합니다 (Joshi, 2009; Harrison, 2020). 그러나 가상 이미지를 사용할 수 없고 잠재적으로 최적의 결과를 얻지 못할 수 있기 때문에 (Ruwanpathirana, 2024) 한계가 있을 수 있습니다 . SPITFIRE™는 PET 이미지 자체에서 공간 해상도를 직접 추정함으로써 이러한 문제를 해결하고 ,대리 팬텀 데이터의 필요성을 제거합니다 .이 방법은 로그 강도 플롯 기법을 3차원으로 일반화하여 축 방향과 평면 방향 모두에서 공간 해상도를 정확하게 추정할 수 있도록 합니다 .다양한 PET 추적자와 스캐너 모델을 포함한 다양한 코호트에 적용했을 때 ,SPITFIRE™는 동일한 스캐너 모델과 재구성 매개변수를 사용하는 피험자 간 최소한의 변동성으로 일관되고 신뢰할 수 있는 공간 해상도 추정치를 입증했습니다 .이 접근법 은 여러 센터에서PET 이미지의 조화를 향상시킬 뿐만 아니라 SPECT와 같은다양한 추적자와 영상 촬영 방식 에 적용할 수 있는 다목적 프레임워크를 제공합니다 .
알츠하이머병 임상시험과 당사의 영상 바이오마커에 대한 신경 영상 활용에 대해 자세히 알아보세요.
관련 콘텐츠
알츠하이머병 영상에 대한 최신 정보 및 알츠하이머병 임상시험에서 치료제의 평가와 관련된 모범 사례에 대해 알아보세요.
알츠하이머병과 경도인지장애(MCI) 환자의 PET 타우(Tau)의 종단적 변화
경도인지장애(MCI)와 알츠하이머병(AD)에서 타우 PET 추적자 흡수 및 결합의 자연적 변화에 대한 개요.