阿尔茨海默病临床试验中的影像学检查 概述
多模态成像广泛应用于阿尔茨海默病(AD)的早期和晚期临床试验。成像的主要用途包括:
- 核磁共振成像
- 资格评估 阅读
- 安全性解读,包括ARIA-E和ARIA-H
- 疗效终点的定量测量(例如容积 核磁共振成像)
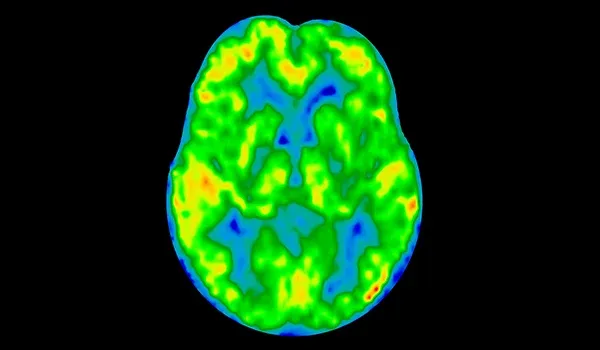
- PET
- 资格与研究人群的丰富性
- 疗效终点的定量测量(例如SUVR 、脑部范围)
在阿尔茨海默氏症的临床试验中成功使用神经影像学需要将严格的研究操作、放射学解读与可靠的数据追踪以及最先进的、经过验证的图像处理和分析软件无缝结合,从而从高质量图像中得出定量测量结果。
阿尔茨海默氏病成像生物标记物
-
- 容积核磁共振成像(区域体积和皮质厚度)
- 淀粉样蛋白PET
- Tau PET
- FDG PET
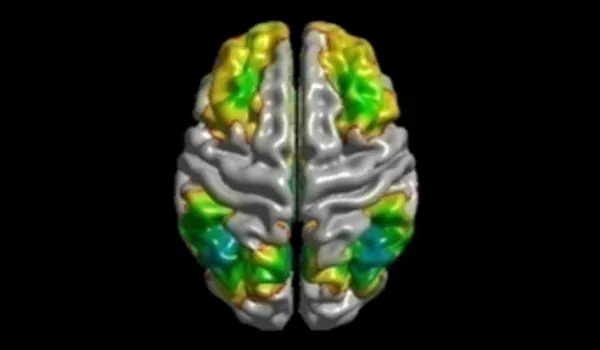
- ASL 灌注 MRI
- fMRI(静息态和基于任务)
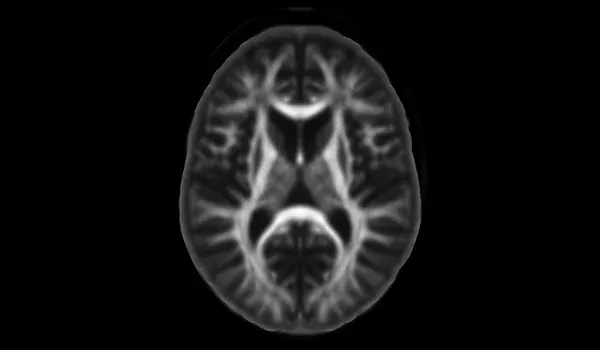
- 扩散成像(如DTI、NODDI、游离水成像)
阿尔茨海默氏病成像研究亮点
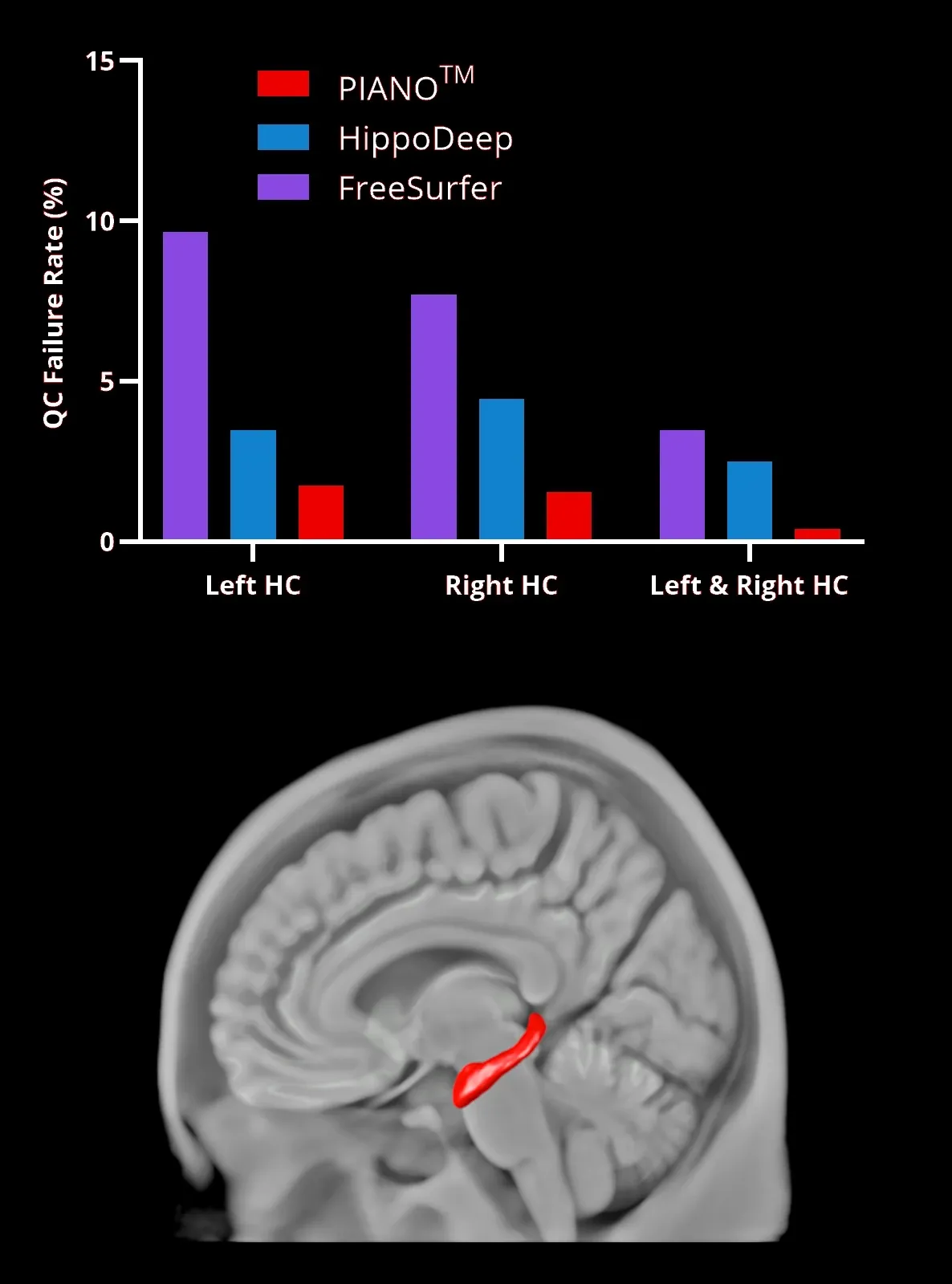
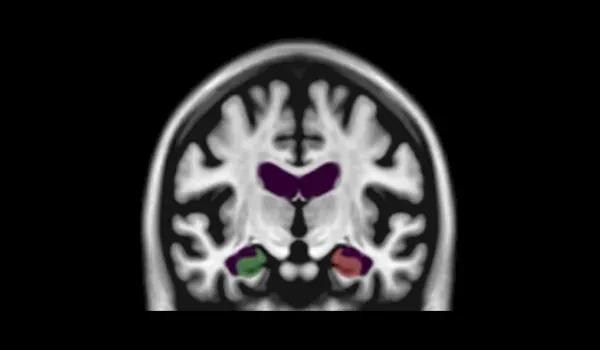
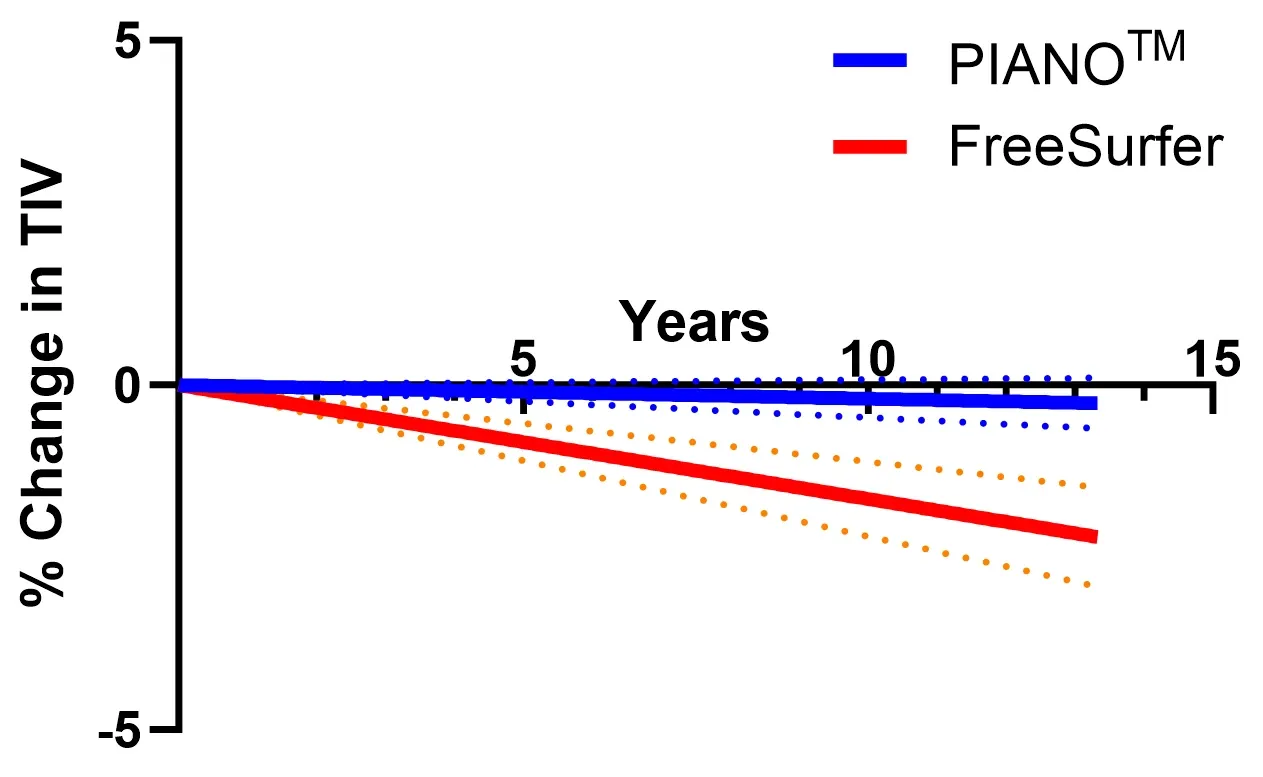
海 马(HC,红色区域以3D呈现 )使用PIANO™ 、HippoDeep和 FreeSurfer分割方法的 分割失败率 。左、右海马表示 在同一数据集中两侧同时分割失败的情况 。
在磁共振图像上对海马进行稳健分割的深度学习
深度学习模型,特别是 卷积神经网络(CNN ),通过模仿人脑的特征 识别过程 ,彻底改变了生物医学图像 处理 。U -Net架构 及其编码器-解码器结构 通过在 真实变形的较小数据集上进行有效训练 ,推动了神经影像学 应用 的发展 ,包括感兴趣区域(ROI) 分割 (Kruger等人,2013;Lindsay,2021 ;Ronneberger等人,2015)。
我们的工作重点是海马分割 ,由于该区域的变化性,尤其是 阿尔茨海默病(AD)患者海马的变化性,这项任务极具挑战性 。我们使用精心挑选的核磁共振扫描数据集,对U-Net模型进行了训练,并通过 质量控制和质量提升训练数据 来丰富模型 。这种方法 提高了 对海马萎缩等 棘手病例的分割精度 ,而之前的模型在这些病例中表现不佳 (Thyreau et al., 2018)。
我们的深度学习模型优于现有的方法 ,例如 FreeSurfer 和 HippoDeep,在没有人工校正的情况下 ,实现 任一半球的 优质 失败率低于2%,且 两个半球均低于 0.4%。 质量控制失败率的显著降低直接 影响临床试验成本,因为较低的数据处理 失败率允许潜在更小的试验样本量 。这种海马分割深度学习 被应用于 FTD数据集 ,展示了 海马内早期快速变化 。
总之,我们的海马分割深度学习 模型 为传统方法 提供了可重复、无偏差的替代方案 ,解决了神经影像学中的难题 ,对更广泛的ROI分割任务具有指导意义。
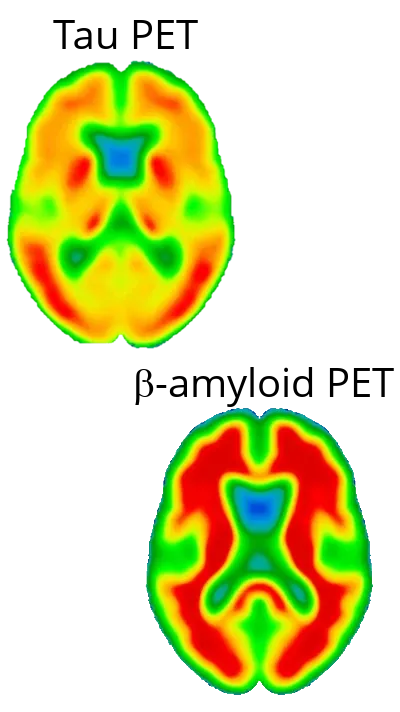
阿尔茨海默氏症(AD)中的神经变性主要由Tau蛋白而非淀粉样蛋白和β驱动
阿尔茨海默氏症(AD)的神经退行性病变越来越 被认为是主要由tau病理 而非淀粉样蛋白(Aβ)沉积 引起的 。虽然淀粉样蛋白斑块 历来被视为AD的特征(Gouras,2015 ),但 它们的存在与 疾病严重程度或神经元损失 并没有很强的相关性 (Gulisano,2018 )。相反 ,神经纤维缠结中过 度磷酸化tau蛋白的积累 与 神经元损伤、认知能力下降和疾病进展 的模式更密切相关 (Liu,2020 ;Moore,2023)。Tau病理 以特定区域的方式 扩散 ,通常从嗅皮层和 海马 开始 ,然后扩散到其他皮层区域 ,与临床症状的进展相一致(Vogels,2020 )。在我们的研究中 ,以皮层厚度作为 神经退行性变 指标的 扩散模型和 相关性分析 有力地支持了tau在驱动 神经退行性变中的作用 。
进一步支持这一论点的是 ,包括靶向tau的治疗策略 ,如tau聚集抑制剂、抗tau抗体和tau激酶,在 临床前和早期临床试验中显示出良好的前景 (Congdon,2023)。
原始PET图像 通过计算平滑内核与 预先定义的通用目标分辨率相协调 。
在无模型临床试验中协调PET图像的空间分辨率
Biospective 公司的SPITFIRE™ 是一种 创新的 计算方法 ,旨在协调 多中心研究 中的脑正电子发射断层扫描(PET)图像 (Carbonell,2024 )。传统方法通常依赖霍夫曼模型数据 来估计空间分辨率(Joshi ,2009 ;Harrison,2020),但由于 模型图像不可用,可能会导致结果不理想 (Ruwanpathirana,2024)。SPITFIRE™ 直接通过 PET 图像本身 来估算空间分辨率 ,无需使用替代的体模数据 ,从而 解决了 这些难题 。这种方法将 对数强度图技术 推广 到 三维空间 ,从而能够精确估算 轴向和平面方向的空间分辨率 。当应用于各种队列,包括不同的 PET示踪剂和扫描仪模型时,SPITFIRE™ 能够提供 一致且可靠的空间分辨率估计 ,且在使用 相同扫描仪模型和重建参数 的受试者之间差异极小 。这种方法 不仅 增强了 不同中心PET图像的协调性 , 还 提供了一个适用于 各种示踪剂和成像模式( 如SPECT)的通用框架 。
了解更多关于阿尔茨海默氏症临床试验中神经影像学的使用以及我们的影像生物标记。
了解更多我们的治疗领域
相关内容
有关阿尔茨海默病成像和阿尔茨海默病临床试验治疗药物评估最佳实践的最新信息。
MCI和阿尔茨海默氏症患者脑部Tau蛋白PET的纵向变化
轻度认知障碍(MCI)和阿尔茨海默氏症(AD)患者对Tau PET示踪剂吸收和结合的自然变化历史概述。