Tauopathies et maladies rares Imagerie dans les essais cliniques Aperçu
L'imagerie multimodale est largement utilisée dans les essais cliniques de phase précoce et tardive des tauopathies (paralysie supranucléaire progressive, dégénérescence corticobasale, démence frontotemporale) et d'autres maladies rares. Les principales utilisations de l'imagerie sont les suivantes :
- IRM
- Critères d'éligibilité
- Lectures de sécurité
- Mesures quantitatives des critères d'efficacité(par exemple , IRMvolumétrique )
- TEP Éligibilité et enrichissement de la population étudiée
- Admissibilité et enrichissement de la population étudiée
- Mesures quantitatives des critères d'évaluation de l'efficacité(par exemple, SUVR , étendue du cerveau)
L'utilisation réussie de la neuro-imagerie dans les essais cliniques sur les tauopathies et les maladies rares nécessite la combinaison harmonieuse d'opérations d'étude rigoureuses, de lectures radiologiques avec un suivi de données robuste et de logiciels de traitement et d'analyse d'images validés et à la pointe de la technologie pour obtenir des mesures quantitatives à partir d'images de haute qualité.
Biomarqueurs d'imagerie pour les tauopathies et les maladies rares
-
- IRM volumétrique (volumes régionaux et épaisseur corticale)
- TEP Tau
- TEP FDG
- Imagerie par diffusion(par exemple, DTI, NODDI, imagerie de l'eau libre)
Points forts de notre recherche sur l'imagerie des maladies rares et des maladies de Tau
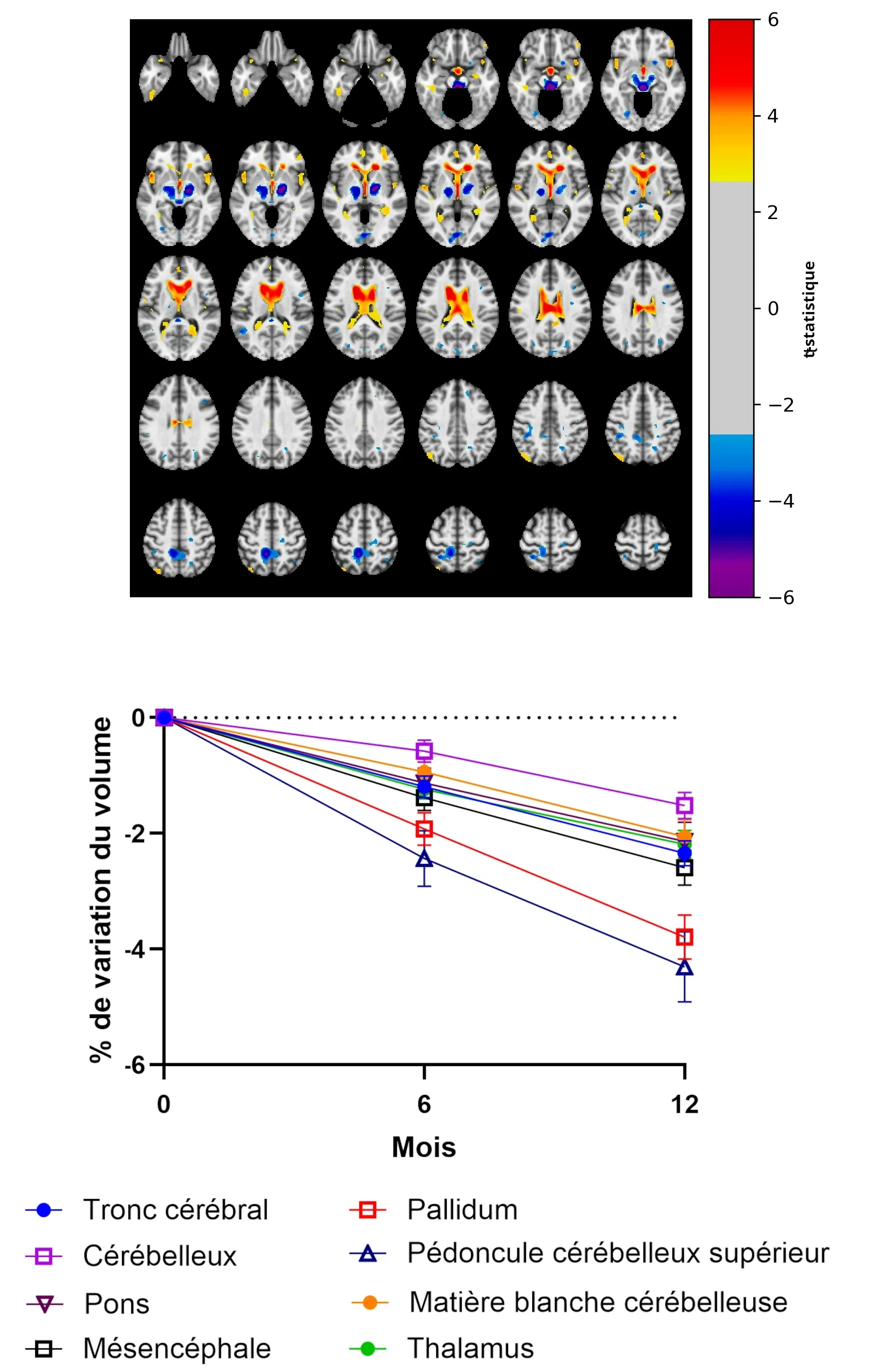
En haut : Vues axiales des cartes de la statistique t comparant le changement des déterminants jacobiens sur une période de 12 mois dans le groupe atteint de paralysie supranucléaire progressive par rapport aux sujets témoins,mettant en évidence l'atrophie (bleu à violet) dans le cervelet, le pont, le mésencéphale et le thalamus, ainsi que l'expansion concomitante des espaces ventriculaires et des sillons adjacents à la région de l'insula (jaune à rouge).
En bas: Variation en pourcentage des données IRM volumétriques régionales entre le début de l'étude et 6 et 12 mois chez les sujets atteints de paralysie supranucléaire progressive.
Mesures IRM de la progression de la maladie pour les essais cliniques sur la paralysie supranucléaire progressive
La paralysie supranucléaire progressive est une maladie neurodégénérative rare caractérisée par des difficultés de mouvement, d'équilibre, d'élocution et de mouvement des yeux. En tant que syndrome parkinsonien atypique, la paralysie supranucléaire progressive se distingue par une accumulation de protéine tau entraînant une détérioration neuronale, en particulier dans le tronc cérébral (Coughlin, 2020). L'atrophie du mésencéphale est une caractéristique clé de la maladie, classiquement identifiée par des caractéristiques radiologiques basées sur l'IRM (Groschel, 2006; Page, 2020). Les changements structurels dans ces régions peuvent être quantifiés à l'aide de mesures planimétriques telles que l'indice de parkinsonisme par résonance magnétique (MRPI) et le MRPI 2.0 (Quattrone, 2018).
En utilisant notre pipeline de traitement d'images automatisé (PIANO™) pour analyser les données d'imagerie de la paralysie supranucléaire progressive de la 4-Repeat Tauopathy Neuroimaging Initiative (4RTNI), nous visons à identifier des biomarqueurs de neuroimagerie fiables pour un diagnostic précoce et à accélérer les évaluations thérapeutiques dans les essais cliniques.
L'analyse volumétrique basée sur l'IRM montre des schémas d'atrophie significatifs et spécifiques à chaque région, ce qui permet de mieux comprendre la progression de la maladie. Par rapport aux biomarqueurs IRM traditionnels, PIANO™ nécessite des échantillons beaucoup plus petits et détecte des changements dès 6 mois après le début de l'étude. Ces résultats soutiennent l'utilisation de l'analyse IRM automatisée pour le diagnostic précoce et les essais cliniques, facilitant une évaluation plus rapide des thérapies modificatrices de la maladie. En améliorant la précision et l'efficacité, cette approche permet un suivi plus efficace de la progression de la maladie et de la réponse thérapeutique.
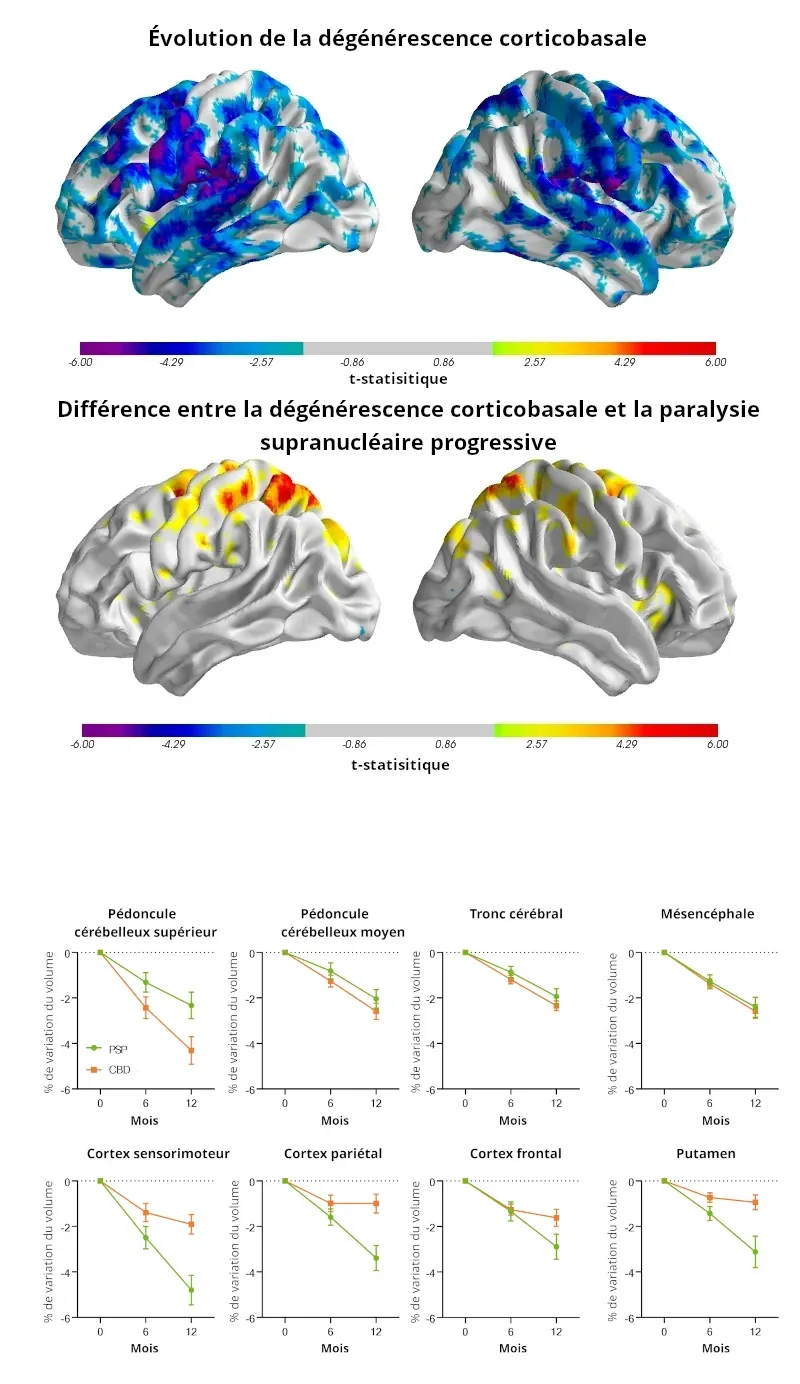
En haut :Projections de surface de l'évolution statistiquement significative (corrigée par FDR, q=0,05) de la densité de matière grise au fil du temps au sein de la population atteinte de dégénérescence corticobasale sur une période de 12 mois, et différence de densité de matière grise dans la population atteinte de paralysie supranucléaire progressive par rapport à la population atteinte de dégénérescence corticobasale à 12 mois.
En bas: le pourcentage de variation des données volumétriques régionales entre le début de l'étude et les mois 6 et 12 est représenté pour les sujets atteints de dégénérescence corticobasale (en vert ) et de paralysie supranucléaire progressive (en orange ) dans un sous-ensemble de régions corticales et sous-corticales
IRM automatisée et biomarqueurs d'imagerie par diffusion pour la dégénérescence corticobasale
La dégénérescence cortic obasale est une maladie neurodégénérative rare caractérisée par une accumulation de protéine tau, entraînant des troubles moteurs et cognitifs progressifs. Les symptômes comprennent des troubles moteurs asymétriques, une dystonie, une apraxie et un syndrome du membre étranger, qui se chevauchent souvent avec la paralysie supranucléaire progressive et la maladie de Parkinson, ce qui rend difficile un diagnostic précis. Sur le plan path ologique , la paralysie supranucléaire progressive affecte principalement le tronc cérébral, tandis que la dégénérescence corticobasale montre une atteinte plus corticale (Dickson, 2002). Les biomarqueurs de neuroimagerie peuvent aider à distinguer ces troubles, à suivre la progression de la maladie et à évaluer l'efficacité du traitement dans les essais cliniques.
Grâce à PIANO™, le pipeline de traitement d'images automatisé de Biospective, nous évaluons les biomarqueurs de neuro-imagerie chez des sujets atteints de dégénérescence corticobasale dans le cadre de la 4-Repeat Tauopathy Neuroimaging Initiative (4RTNI). L'analyse voxel par voxel et l'analyse de l'atrophie régionale révèlent des schémas d'atrophie spécifiques à la maladie : Les sujets atteints de paralysie supranucléaire progressive présentent une atrophie plus importante du tronc cérébral et du pédoncule cérébelleux (2 à 4 % sur 12 mois), tandis que les sujets atteints de dégénérescence corticobasale présentent une atrophie plus importante du cortex (3 à 5 %).
Les modifications de l'IRM de diffusion chez les sujets atteints de dégénérescence corticobasale montrent une détérioration microstructurelle rapide, en particulier dans la substance blanche pariétale et les régions corticales.L'analyse volumétrique basée sur PIANO™ nécessite des échantillons de taille nettement plus petite (moins de 50 sujets par bras) par rapport à FreeSurfer pour détecter une réduction de 60 à 80 % de la progression de la maladie.
Ces résultats confirment que l'analyse automatisée de l'IRM anatomique et de l'imagerie par diffusion sont des biomarqueurs prometteurs pour le diagnostic précoce et l'évaluation thérapeutique dans les essais cliniques sur la dégénérescence corticobasale.
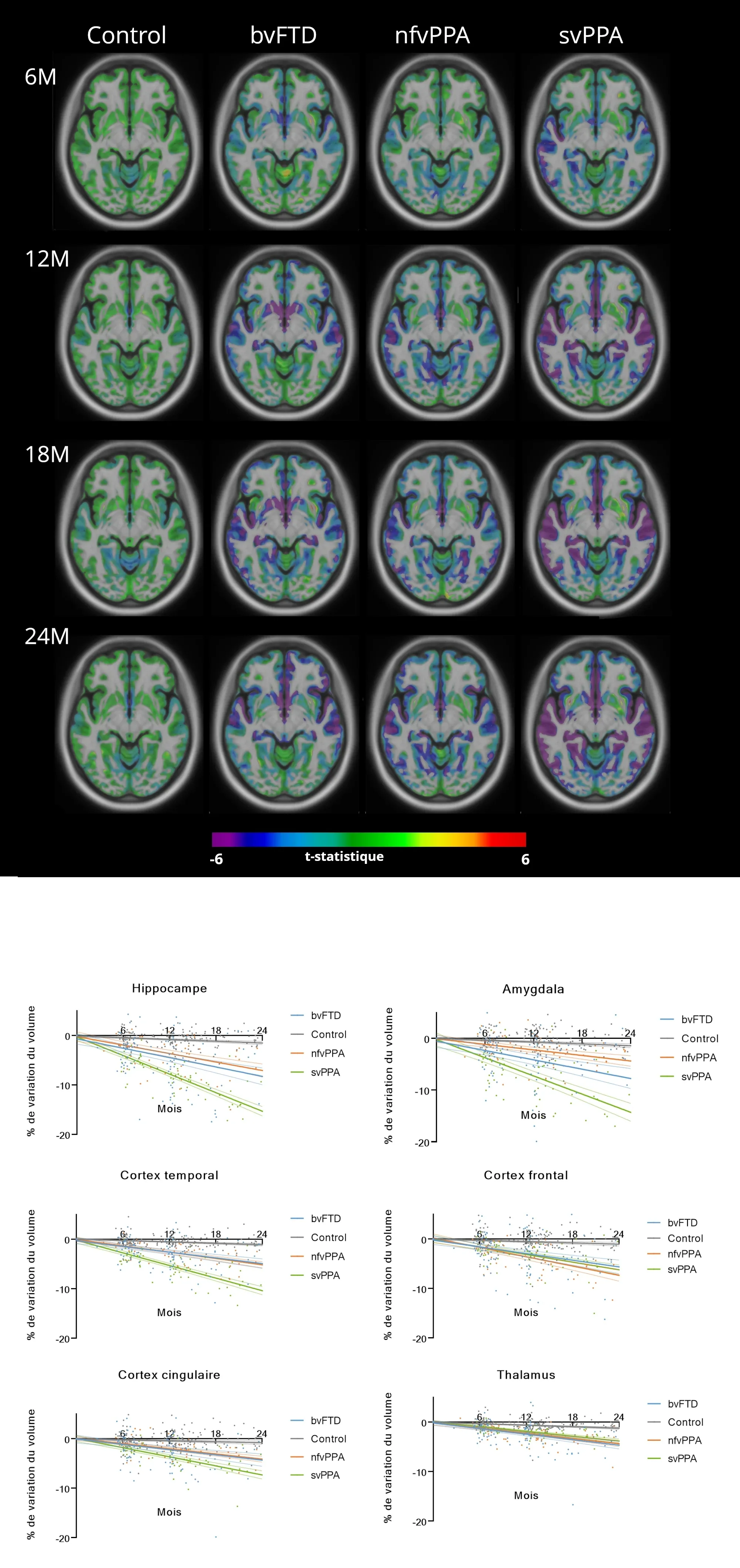
En haut : Les cartes de la statistique t de densité de matière grise superposées sur un modèle anatomique d'IRM illustrent le changement statistiquement significatif (FDR = 0,05) de densité de matière grise au fil du temps. Les comparaisons mettent en évidence les variations spatiales(de gauche à droite) et temporelles(de haut en bas) des changements de densité de matière grise en comparant les populations de contrôle , bvFTD,nfvPPA et svPPAsur 6, 12, 18 et 24 mois.
En bas : le pourcentage de variation des données volumétriques régionales entre le début de l'étude et 24 mois est représenté en comparant les trois variantes de DFT : bvFTD (bleu ), nfvPPA (orange) et svPPA (vert), avec des sujets témoins sains (gris) dans un sous-ensemble de régions corticales et sous-corticales.
Biomarqueurs d'imagerie par résonance magnétique (IRM) et par diffusion automatisés pour la démence frontotemporale
La démence frontotemporale (DFT) est un groupe hétérogène (clinique et pathologique) de troubles neurodégénératifs progressifs caractérisés par une dégénérescence des lobes frontaux et temporaux du cerveau et des changements progressifs du comportement, du langage et de la cognition. Les trois principaux sous-types cliniques sont la variante comportementale de la DFT (bvFTD), l'aphasie primaire progressive non fluente (nfvPPA) et l'aphasie primaire progressive sémantique (svPPA).
Le diagnostic et le suivi précis des variantes de la DFT, y compris la variante comportementale de la DFT (bvFTD), l'aphasie primaire progressive non fluente (nfvPPA) et l'aphasie primaire progressive sémantique (svPPA) (Hogan, 2016; Leroy, 2021), restent difficiles. Les biomarqueurs de neuroimagerie peuvent aider au diagnostic différentiel et à l'évaluation de la progression de la maladie.
Nous utilisons PIANO™, le pipeline de traitement d'images entièrement automatisé de Biospective, pour analyser les données d'IRM et d'IRM de diffusion (IRMd) des participants à la base de données de l'Initiative de neuroimagerie de la dégénérescence lobaire frontotemporale (FTLDNI). Les mesures quantitatives de volume et de diffusivité permettent d'identifier une atrophie spatiale distincte et des changements microstructurels dans les différents sous-types de DFT.
Nos principales conclusions
- Les mesures an atomiques de l'atrophie dérivées de l'IRM permettent de différencier efficacement les variantes de la DFT.
- Les mesures de diffusion par IRM, y compris la diffusivité et l'eau libre, fournissent des informations supplémentaires sur la dégénérescence microstructurelle.
- Les sous-types de DFT présentent des schémas d'atrophie régionale distincts, la DFTb montrant une atrophie frontale étendue, la DFTnf affectant le gyrus frontal inférieur et la DFTsv ayant un impact sur les lobes temporaux antérieurs.
- PI ANO™ nécessite des échantillons beaucoup plus petits que les méthodes d'analyse traditionnelles, ce qui permet de détecter rapidement les changements structurels et de réduire les coûts des essais cliniques.
Ces résultats confirment l'utilisation de l'IRM automatisée et de l'imagerie par diffusion en tant que biomarqueurs fiables pour le diagnostic précoce et l'évaluation thérapeutique dans les essais cliniques sur la DFT. Cette approche facilite l'évaluation efficace de la progression de la maladie et des effets potentiels du traitement, ce qui en fait un outil précieux pour les études multicentriques.
Apprenez-en d'avantage sur l'utilisation de la neuro-imagerie dans les essais cliniques sur les tauopathies et sur nos biomarqueurs d'imagerie.
Découvrez nos autres domaines thérapeutiques
Contenu connexe
Informations actualisées sur les Tauopathies et les maladies rares Imagerie et meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les essais cliniques.
Mesures IRM de la progression de la maladie pour les essais cliniques sur la PSP
Biomarqueurs IRM (y compris l'atrophie cérébrale) issus des études 4RTNI et FTLDNI sur l'histoire naturelle de la paralysie supranucléaire progressive (PSP).
IRM et dégénérescence corticobasale (CBD)
Mesures longitudinales de l'atrophie cérébrale par IRM provenant des études 4RTNI et FTLDNI, y compris le calcul de la taille des échantillons pour les essais cliniques sur la dégénérescence corticobasale.
Démence frontotemporale (DFT) et atrophie cérébrale par IRM
Biomarqueurs IRM (y compris l'atrophie cérébrale) issus des études FTLDNI sur l'histoire naturelle de la démence frontotemporale (DFT).
IRM de diffusion et démence frontotemporale (DFT)
Analyse de la neuroimagerie de diffusion à partir de l'étude FTLDNI sur l'histoire naturelle de la démence frontotemporale (DFT)